Questões Sobre Biomoléculas e Bioquímica - Biologia - concurso
251) Durante estudo das velocidades de hidrólise da sacarose pela enzima ß-frutofuranosidase de leveduras, Adrian Brown observou que quando a concentração de sacarose é muito maior que a concentração da enzima a velocidade da reação enzimática se torna independente da concentração de sacarose. Nestas condições, qual será a ordem da velocidade da reação enzimática em relação à sacarose?
- A) ordem zero.
- B) primeira ordem.
- C) segunda ordem.
- D) terceira ordem.
- E) ordem mista.
A alternativa correta é letra A) ordem zero.
Isso ocorre porque, em altas concentrações de sacarose, a enzima ß-frutofuranosidase está saturada com o substrato sacarose. Nesse ponto, todas as moléculas da enzima estão ocupadas no processo catalítico, e adicionar mais sacarose não aumenta a velocidade da reação. Portanto, a velocidade da reação se torna independente da concentração de sacarose, caracterizando uma cinética de ordem zero, onde a velocidade é constante e não é afetada pela concentração do substrato.
252) Assinale a alternativa INCORRETA. A inibição enzimática reversível é caracterizada por um equilíbrio estabelecido muito rapidamente entre enzima e inibidor. Os principais tipos de inibição reversível são classificados em:
- A) inibição incompetitiva.
- B) inibição competitiva.
- C) inibição intercompetitiva.
- D) inibição não-competitiva.
- E) inibição acompetitiva.
Resposta: A alternativa correta é letra C) inibição intercompetitiva.
Explicação: A inibição enzimática reversível ocorre quando um inibidor se liga temporariamente a uma enzima, impedindo-a de catalisar uma reação química. Existem três tipos principais de inibição reversível: competitiva, não-competitiva e incompetitiva. A inibição competitiva acontece quando o inibidor se liga ao sítio ativo da enzima, competindo com o substrato. Na inibição não-competitiva, o inibidor se liga a um local diferente, não interferindo na ligação do substrato, mas ainda assim impedindo a atividade enzimática. A inibição incompetitiva é um caso especial onde o inibidor só pode se ligar à enzima quando o substrato está presente, também impedindo a ação da enzima.
A opção 'C' menciona 'inibição intercompetitiva', que não é um termo reconhecido na bioquímica, tornando-a a alternativa incorreta.
253) O metabolismo celular depende da síntese e da atuação de um conjunto específico de macromoléculas denominadas de enzimas. As enzimas são classificadas como:
- A) ácidos nucleicos.
- B) ácidos graxos.
- C) ácidos orgânicos.
- D) proteínas.
- E) carboidratos.
A alternativa correta é letra D) proteínas.
Essa questão exige conhecimentos em Bioquímica.
Questão bem tranquila, que simplesmente pergunta a classificação bioquímica das enzimas.
Como bem se sabe, enzimas são proteínas com poder catalítico.
Vale ressaltar que existem RNAs com poder catalítico, as ribozimas, que também são enzimas.
ENUNCIADO/COMANDO:
O metabolismo celular depende da síntese e da atuação de um conjunto específico de macromoléculas denominadas de enzimas. As enzimas são classificadas como:
A alternativa que atende ao comando é a Alternativa D.
FONTE: REECE, Jane B. et al. Biologia de Campbell. 10 ed. Porto Alegre: Artmed, 2015.
Questão 254
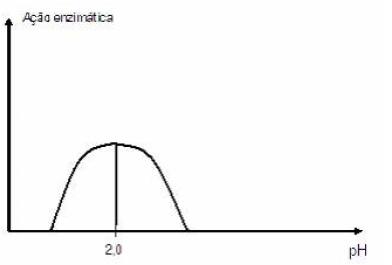
O nome, o substrato e o local de ação dessa enzima são, respectivamente,
- A) amilase salivar, amido, boca.
- B) pepsina, proteína, estômago.
- C) lìpase, lipídio, intestino delgado.
- D) sacarase, sacarose, intestino delgado.
A alternativa correta é letra B) pepsina, proteína, estômago.
a) amilase salivar, amido, boca.
INCORRETA: A amilase salivar é uma enzima que atua na boca e tem um pH ótimo em torno de 6,5 a 7,4. No gráfico a ação da enzima tem o seu pico em pH 2, indicando o funcionamento em ambiente ácido.
b) pepsina, proteína, estômago.
CORRETA: O gráfico apresenta uma enzima com pico de ação quando o pH é 2. Isso sugere um ambiente muito ácido, o que é característico do estômago. Esse ambiente ácido no estômago é crucial para a ativação e funcionamento eficiente da pepsina, que desempenha um papel fundamental na digestão de proteínas.
c) lìpase, lipídio, intestino delgado.
INCORRETA: A lipase é uma enzima que atua na digestão de lipídios, e sua atividade é otimizada em um ambiente mais alcalino, o que é mais característico do intestino delgado. Portanto, não corresponde ao que ilustra o gráfico, pois o pH ótimo mencionado no gráfico é 2.
d) sacarase, sacarose, intestino delgado.
INCORRETA: A ação da sacarase ocorre no intestino delgado, mas seu pH ótimo geralmente está próximo a 6,5 a 7,5. A alternativa está incorreta com base no pH ótimo mencionado no gráfico que é 2.
Questão 255
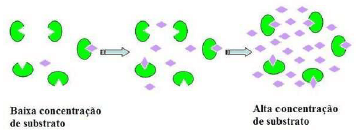
Fonte:
https://www.wikiwand.com/pt/Cin%C3%A9tica_enzim%C3%A
1tica
- A) uma reação enzimática típica é linear, ou seja, a velocidade de reação enzimática aumenta conforme a maior quantidade de substrato.
- B) as enzimas aceleram reações, frequentemente por fatores de milhões de vezes ou mais, sem que elas próprias sejam modificadas, ou seja, as enzimas permitem que sejam feitas e desfeitas ligações de hidrogênio facilmente.
- C) a enzima da coagulação sanguínea, a trombina, quebra a cadeia de apenas um tipo de proteína do sangue, entre um resíduo particular de arginina e uma glicina adjacente. Essa enzima pode ser classificada como isomerases.
- D) há um limite para a quantidade de substrato que uma única molécula de enzima pode processar em um dado tempo, podendo aumentar a velocidade conforme a disponibilidade de substrato, porém limitada pela rapidez da enzima em processar a molécula de substrato.
A alternativa correta é letra D) há um limite para a quantidade de substrato que uma única molécula de enzima pode processar em um dado tempo, podendo aumentar a velocidade conforme a disponibilidade de substrato, porém limitada pela rapidez da enzima em processar a molécula de substrato.
a) uma reação enzimática típica é linear, ou seja, a velocidade de reação enzimática aumenta conforme a maior quantidade de substrato.
INCORRETA: Na verdade, a relação entre a velocidade da reação enzimática e a concentração do substrato não é linear. Inicialmente, com o aumento da concentração do substrato, a velocidade da reação aumenta proporcionalmente até atingir um ponto de saturação. Nesse ponto, todas as moléculas de enzima estão ocupadas e a velocidade da reação se estabiliza, independentemente de aumentar ainda mais a concentração do substrato.
b) as enzimas aceleram reações, frequentemente por fatores de milhões de vezes ou mais, sem que elas próprias sejam modificadas, ou seja, as enzimas permitem que sejam feitas e desfeitas ligações de hidrogênio facilmente.
INCORRETA: A capacidade das enzimas de aumentar a velocidade das reações é notável, mas é mais comum que elas o façam em uma faixa de aumento de centenas a milhares de vezes e não como afirma a alternativa, em milhões de vezes.
c) a enzima da coagulação sanguínea, a trombina, quebra a cadeia de apenas um tipo de proteína do sangue, entre um resíduo particular de arginina e uma glicina adjacente. Essa enzima pode ser classificada como isomerases.
INCORRETA: A trombina não é uma isomerase, mas sim uma serina protease, que desempenha um papel crucial na cascata de coagulação sanguínea, convertendo o fibrinogênio, uma proteína solúvel no sangue, em fibrina, que forma uma rede de filamentos insolúveis que estabilizam o coágulo sanguíneo.
d) há um limite para a quantidade de substrato que uma única molécula de enzima pode processar em um dado tempo, podendo aumentar a velocidade conforme a disponibilidade de substrato, porém limitada pela rapidez da enzima em processar a molécula de substrato.
CORRETA: A atividade enzimática é limitada pela quantidade de enzima disponível e pela velocidade com que a enzima pode processar o substrato. Ou seja, existe uma capacidade máxima de saturação, na qual todas as moléculas de enzima estão ocupadas com substrato e a velocidade da reação está em seu máximo. Além desse ponto, aumentar a concentração do substrato não aumentará mais a velocidade da reação, pois a enzima estará operando em sua capacidade máxima.
256) As enzimas são proteínas conhecidas como catalisadores biológicos devido à sua capacidade de promover reações de maneira mais rápida e eficiente. Qual é a enzima responsável por biotransformar a sacarose em glicose + frutose?
- A) Lipase.
- B) Descarboxilase.
- C) Sintetase.
- D) Invertase.
- E) Lactase.
A alternativa correta é letra D) Invertase.
As diversas enzimas citadas, apenas uma atua na hidrólise da sacarose, como evidencia-se a seguir:
a) Lipase: atuam na hidrólise de lipídeos.
b) Descarboxilase: retirada de grupo carboxila de compostos orgânicos.
c) Sintetases são enzimas envolvidas na ligação de molécula/síntese e não na hidrólise.
d) Invertase: hidrolisa a sacarose em glicose + frutose.
e) Lactase: hirolisa a lactose em glicose + galactose.
Questão 257
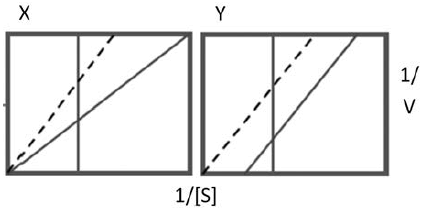
- A) O gráfico X mostra uma inibição não competitiva, onde o inibidor se liga a um sítio distinto do sítio catalítico, formando complexo EI, e o Y uma inibição irreversível.
- B) o gráfico X mostra uma inibição competitiva, onde o inibidor compete com o substrato e o Y uma inibição mista, onde o inibidor se liga à enzima ou ao complexo enzima-substrato (EI e/ou ESI).
- C) O gráfico X mostra uma inibição não competitiva, onde o inibidor se liga ao mesmo sítio que o substrato, e o Y uma inibição mista, onde o inibidor se liga a um sítio distinto do sítio catalítico, sem formar complexos.
- D) O gráfico X mostra uma inibição não competitiva, onde o inibidor se liga a um sítio distinto do sítio catalítico formando o complexo EI, e o Y uma inibição mista, onde o inibidor se liga à enzima ou ao complexo enzima-substrato (EI e/ou ESI).
- E) O gráfico X mostra uma inibição irreversível, onde o inibidor se liga covalentemente à enzima, e o Y uma inibição competitiva, onde o inibidor compete com o substrato.
ESTA QUESTÃO FOI ANULADA, NÃO POSSUI ALTERNATIVA CORRETA
As representações de gráficos de Lineweaver-Burk (duplos-recíprocos) para a atividade enzimática com ou sem inibidores (que podem ser do tipo competitivo ou não competitivo) estão representadas na figura abaixo:
Concluímos que em X temos um caso de inibidor não competitivo e em Y temos um caso de inibidor competitivo.
Os inibidores competitivos retardam o progresso da reação ao se ligar à enzima, geralmente no sítio ativo.
Os inibidores não competitivos não impedem que o substrato se ligue à enzima, porém, quando o inibidor está ligado, a enzima não consegue catalisar sua reação para produzir um produto.
Vamos analisar as alternativas apresentadas.
a) O gráfico X mostra uma inibição não competitiva, onde o inibidor se liga a um sítio distinto do sítio catalítico, formando complexo EI, e o Y uma inibição irreversível.
ERRADO. Em X temos a ligação de um inibidor não competitivo, que se liga em sitio catalítico distinto do sítio catalítico e impede a enzima de realizar seu trabalho. Em Y não temos um inibidor irreversível.
b) o gráfico X mostra uma inibição competitiva, onde o inibidor compete com o substrato e o Y uma inibição mista, onde o inibidor se liga à enzima ou ao complexo enzima-substrato (EI e/ou ESI).
ERRADO. Em X temos a ligação de um inibidor não competitivo.
c ) O gráfico X mostra uma inibição não competitiva, onde o inibidor se liga ao mesmo sítio que o substrato, e o Y uma inibição mista, onde o inibidor se liga a um sítio distinto do sítio catalítico, sem formar complexos. ERRADO. Em X temos a ligação de um inibidor não competitivo, que se liga em sitio catalítico distinto do sítio catalítico e impede a enzima de realizar seu trabalho.
d) O gráfico X mostra uma inibição não competitiva, onde o inibidor se liga a um sítio distinto do sítio catalítico formando o complexo EI, e o Y uma inibição mista, onde o inibidor se liga à enzima ou ao complexo enzima-substrato (EI e/ou ESI).
ERRADO. Quanto a X tudo certo. Mas, em Y não temos inibição mista.
e) O gráfico X mostra uma inibição irreversível, onde o inibidor se liga covalentemente à enzima, e o Y uma inibição competitiva, onde o inibidor compete com o substrato.
ERRADO. Em X temos a ligação de um inibidor não competitivo, que se liga em sitio catalítico distinto do sítio catalítico e impede a enzima de realizar seu trabalho. Não é uma inibição irreversível. Quanto a Y, tudo certo.
Sem resposta correta, por isso, a anulação da questão.
258) Além de fundamentais para a manutenção da vida das células, as enzimas são biomoléculas utilizadas em processos industriais de diferentes áreas, como a de alimentos, papel, têxteis e medicamentos.
- A) Agem de forma pouco específica, podendo uma mesma enzima ligar-se a substratos diversos.
- B) Podem atuar fora da célula, pois não sofrem interferência das condições físico- químicas do meio.
- C) Reduzem a energia de ativação de uma reação química, aumentando sua velocidade.
- D) Aumentam a concentração dos substratos, permitindo que a reação química ocorra espontaneamente.
- E) Aumentam a temperatura de um sistema químico, facilitando a ocorrência da reação.
A alternativa correta é letra C) Reduzem a energia de ativação de uma reação química, aumentando sua velocidade.
Gabarito da banca: Letra "C"
Entendimento: Letra "C"
Acompanhe nossa análise:
A única resposta correta é a assertiva C. Anote aí:
Uma enzima é uma macromolécula que atua como catalisador, agente químico que acelera a reação sem ser consumido por ela. Neste capítulo, vamos enfocar as enzimas proteicas. (Algumas moléculas de RNA, chamadas de riboenzimas, podem atuar como enzimas [...]. Sem a regulação pelas enzimas, o tráfego químico pelas rotas do metabolismo se tornaria terrivelmente congestionado, pois algumas reações demorariam muito tempo. [...].
Proteínas, DNA e outras moléculas complexas da célula são ricas em energia livre e têm potencial para se decomporem espontaneamente; isto é, as leis da termodinâmica favorecem sua degradação. Essas moléculas persistem apenas porque, na temperatura típica das células, poucas con-seguem transpor a barreira de energia de ativação. Todavia, em alguns momentos, as barreiras de certas reações devem ser superadas para que as células realizem o trabalho necessário para a vida. O calor acelera as reações permitindo que os reagentes alcancem o estado de transição com mais frequência, mas essa solução é inapropriada para os sistemas biológicos. Em primeiro lugar, altas temperaturas desnaturam proteínas e matam as células. Depois, o calor irá acelerar todas as reações e não apenas as necessárias. Os organismos, então, utilizam uma alternativa para acele-rar reações: a catálise. (p. 151-152, grifo nosso).
Referência: REECE, J. B. et al. Biologia de Campbell. 10. ed. Porto Alegre: Artmed, 2015.
Veja o esquema (p. 152):
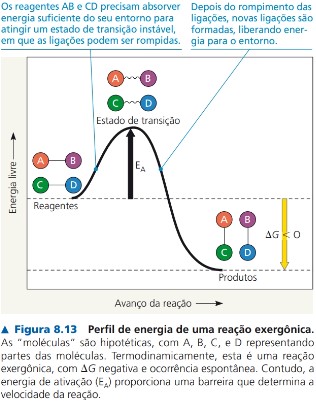
Referência: REECE, J. B. et al. Biologia de Campbell. 10. ed. Porto Alegre: Artmed, 2015.
259) As enzimas são substâncias proteicas, denominadas catalisadores biológicos que facilitam que reações metabólicas aconteçam e reduzam a taxa de energia de ativação dos reagentes, os substratos enzimáticos. As enzimas, também consideradas biomoléculas, são classificadas de acordo com determinados critérios, sendo a afinidade e a ação ao substrato, os principais atributos para essa classificação. Dentre as alternativas abaixo, assinale aquela que apresenta a afirmativa incorreta quanto à classificação do tipo de enzimático a que se refere.
- A) Isomerases: enzimas realizam reações de interconversão das substâncias isoméricas, quer sejam essas substâncias isômeros geométricos ou isômeros ópticos, como: as epimerases.
- B) Oxidorredutases: enzimas que realizam as transferências de elétrons através de reações químicas de oxirredução, como: as desidrogenases.
- C) Liases: enzimas que formam novas moléculas, unificando duas pré-existentes, como: as sintetases.
- D) Transferases: enzimas que efetuam a translocação de grupamentos funcionais (amina, carbonila, carboxila, fosfato) de uma molécula para outra, como: as quinases.
A alternativa correta é letra C) Liases: enzimas que formam novas moléculas, unificando duas pré-existentes, como: as sintetases.
A questão pede qual das afirmativas está INCORRETA, vamos explicar cada uma a seguir:
a) Isomerases: enzimas realizam reações de interconversão das substâncias isoméricas, quer sejam essas substâncias isômeros geométricos ou isômeros ópticos, como: as epimerases.
Esta afirmação está CORRETA. As isomerases são um tipo de enzima que catalisa reações de interconversão de isômeros, que podem ser isômeros geométricos (que têm diferenças na disposição espacial dos átomos) ou isômeros ópticos (que têm diferentes orientações das moléculas na forma tridimensional). Um exemplo de isomerase é a epimerase, que converte epímeros, que são isômeros que diferem na orientação de grupos em apenas um carbono assimétrico.
b) Oxidorredutases: enzimas que realizam as transferências de elétrons através de reações químicas de oxirredução, como: as desidrogenases.
Esta afirmação também está CORRETA. As oxidorredutases são um grupo de enzimas que catalisam reações de oxirredução, envolvendo a transferência de elétrons de uma molécula para outra. As desidrogenases são um exemplo de oxidorredutases, pois catalisam a remoção de átomos de hidrogênio (e seus elétrons) de uma molécula, geralmente transferindo esses elétrons para um receptor adequado.
c) Liases: enzimas que formam novas moléculas, unificando duas pré-existentes, como: as sintetases.
Está INCORRETA. As liases são um tipo de enzima que catalisa reações de quebra de ligações químicas em moléculas orgânicas ou a formação de ligações duplas, sem envolver a transferência direta de grupos funcionais para outra molécula. As liases atuam geralmente em reações de eliminação, em que uma molécula é dividida em duas partes ou em reações de adição, em que duas moléculas são unidas para formar uma única molécula.
d) Transferases: enzimas que efetuam a translocação de grupamentos funcionais (amina, carbonila, carboxila, fosfato) de uma molécula para outra, como: as quinases.
Esta afirmação também está CORRETA. As transferases são um tipo de enzima que catalisa a transferência de grupos funcionais de uma molécula para outra. As quinases são um exemplo de transferases que catalisam a transferência de grupos fosfato de uma molécula doador para uma molécula aceitadora, desempenhando um papel importante na fosforilação de proteínas, regulando assim várias funções celulares.
260) Enzimas são proteínas que aceleram a taxa das reações químicas em uma célula, o que contribui para o metabolismo do organismo como um todo. Sem as enzimas, muitas reações seriam extremamente lentas. Acerca da atividade enzimática, assinale a alternativa incorreta:
- A) Isoenzimas são enzimas que catalisam a mesma reação, mas sob condições diferentes ou em tecidos diferentes
- B) A atividade enzimática pode ser modulada por fatores químicos ou por mudanças na temperatura e no pH
- C) Oxidase é uma enzima que catalisa uma reação de oxidação-redução envolvendo oxigênio molecular como aceptor de elétrons
- D) Em uma reação enzimática, o estado de equilíbrio é atingindo quando a razão entre enzima e produto é sempre a mesma
A alternativa correta é letra D) Em uma reação enzimática, o estado de equilíbrio é atingindo quando a razão entre enzima e produto é sempre a mesma
a) Isoenzimas são enzimas que catalisam a mesma reação, mas sob condições diferentes ou em tecidos diferentes
CORRETA: Isoenzimas são formas diferentes de uma enzima que catalisam a mesma reação química, mas podem estar presentes em diferentes tecidos ou condições. As isoenzimas compartilham a mesma atividade catalítica, mas têm diferenças em sua estrutura primária ou quaternária, o que resulta em diferentes propriedades físicas ou cinéticas.
b) A atividade enzimática pode ser modulada por fatores químicos ou por mudanças na temperatura e no pH
CORRETA: A atividade enzimática é altamente sensível a diversos fatores, incluindo fatores químicos, temperatura e pH, que juntamente com modulações adequadas são essenciais para manter as condições ótimas para a eficiência catalítica das enzimas no metabolismo celular.
c) Oxidase é uma enzima que catalisa uma reação de oxidação-redução envolvendo oxigênio molecular como aceptor de elétrons
CORRETA: A oxidação é uma reação química em que ocorre a perda de elétrons, enquanto a redução envolve o ganho de elétrons. As enzimas chamadas oxidases são responsáveis por catalisar reações de oxidação-redução, onde o oxigênio molecular atua como aceptor final de elétrons.
d) Em uma reação enzimática, o estado de equilíbrio é atingindo quando a razão entre enzima e produto é sempre a mesma
INCORRETA: Em uma reação enzimática, o estado de equilíbrio não é alcançado quando a razão entre enzima e produto é sempre a mesma. O equilíbrio em uma reação química ocorre quando a taxa da reação direta é igual à taxa da reação inversa. Nas reações enzimáticas, o equilíbrio não é caracterizado por uma razão constante entre enzima e produto, pois as enzimas estão constantemente envolvidas na catalisação de reações e não permanecem estáveis em relação aos produtos. O equilíbrio ocorre nas concentrações relativas de substrato e produto.
