Questões Sobre Biomoléculas e Bioquímica - Biologia - concurso
Questão 301
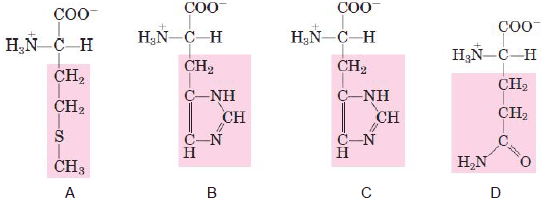
Com relação aos quatro aminoácidos, podemos afirmar que
- A) o aminoácido A é o único com cadeia lateral não-polar.
- B) os aminoácidos A e C possuem cadeias laterais não-polares.
- C) o aminoácido B é o único com cadeia lateral não-polar.
- D) todos os aminoácidos possuem cadeias laterais não-polares.
302) Quando fritamos um ovo, a proteína presente na clara (Ovalbumina) muda sua forma em função do calor a que o ovo é submetido. Esse processo é conhecido como
- A) inibição alostérica.
- B) renaturação.
- C) desnaturação.
- D) agregação.
Resposta: C) desnaturação.
Explicação: A desnaturação é o processo pelo qual as proteínas perdem sua estrutura tridimensional em função de alterações ambientais, como mudanças de pH, salinidade ou temperatura. No caso da clara do ovo, a ovalbumina é desnaturada pelo calor quando o ovo é frito, o que resulta na mudança de sua forma e no endurecimento da clara. Esse processo é irreversível e diferente da renaturação, que seria o retorno à forma original sob condições ideais.
303) Aminoácidos são chamados ácidos porque
- A) contêm grupos carboxil na sua estrutura geral.
- B) contêm grupos carboxil na sua cadeia lateral.
- C) contêm grupos amino na sua estrutura geral.
- D) contêm grupos amino na sua cadeia lateral.
- E) atuam como ácido quando estão ligados a proteínas.
A alternativa correta é letra A) contêm grupos carboxil na sua estrutura geral.
Gabarito da banca: Letra "A"
Entendimento: Letra "A"
Acompanhe minha análise:
Há vinte aminoácidos que podem participar da formação das proteínas e serem incorporados durante a sua síntese nos ribossomos [...]. Todos eles são α-aminoácidos, sendo que o carbono α é o primeiro carbono ligado à carboxila, ou seja, o segundo carbono da molécula (a partir dele, são nomeados os carbonos β, γ, δ e ϵ) e se apresentam na forma L (o carbono α é assimétrico em todos, menos na glicina, cuja cadeia lateral é um hidrogênio).
Em que R é a parte variável da molécula.
Em pH ácido (menor que 7), o grupo carboxila se ioniza, ou seja, perde seu próton (a pH 2-2,5, 50% deles já se encontram ionizados), enquanto o grupo amina está protonado (tem fraco caráter ácido, ou seja, é capaz de doar prótons. Sua maioria fica ionizada apenas em pH acima de 9).
Deste modo, os L-α-aminoácidos podem apresentar caráter ácido (até diácido, pois podem perder o próton da carboxila e o próton da amina), ou caráter básico (podem receber prótons). Essa característica dupla de um composto (funcionar como ácido e base) o classifica como composto anfótero (p. 23, grifo meu).
A imagem aumenta a sua compreensão:
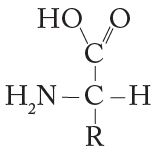
Referência: CARVALHO, H. F.; RECCO-PIMENTEL, S. M. A Célula. 4. ed. Barueri Manole, 2019.
Portanto: Letra "A". Mas se lembre que o aminoácido é um composto anfótero.
304) A forma helicoidal de proteínas é estabilizada, geralmente, por ligações entre
- A) S e S.
- B) cadeias laterais.
- C) CO e NH.
- D) moléculas de água.
- E) grupos iônicos.
A alternativa correta é letra C) CO e NH.
Gabarito da banca: Letra "C"
Entendimento: Letra "C"
Acompanhe minha análise:
A imagem mostra claramente a ligação entre CO e NH. Antes, relembre que:
As propriedades físico-químicas e as funções das proteínas têm relação direta com a sua composição em aminoácidos. Por esse motivo, é de extrema importância o conhecimento da sequência com que eles são incorporados à molécula durante a síntese proteica para formar a estrutura tridimensional do polipeptídeo. Didaticamente, a sequência de aminoácidos de uma proteína é denominada estrutura primária da proteína. É bastante comum a utilização do código de três letras ou, com mais frequência, o de uma letra para a apresentação da estrutura primária das proteínas.
Na natureza, uma proteína nativa terá outras interações e ligações além das ligações peptídicas. Essa estrutura tridimensional lhe confere e possibilita a função desempenhada. Assim, as proteínas estruturais são mais fibrilares que as proteínas de reserva ou as enzimas, por exemplo.
O primeiro tipo de interação que ocorre é decorrente da própria ligação peptídica, que possui um caráter de dupla-ligação estendida entre os átomos de oxigênio e nitrogênio.
[...]
Uma [estrutura] bastante comum, denominada α-hélice (Figura 3.17), ocorre quando esses ângulos se situam em valores entre -45 e -60º. Consiste de uma estrutura helicoidal (como o nome salienta) de tal sorte que ocorre uma volta completa sobre um eixo imaginário a cada 3,6-3,7 aminoácidos e cada novo turno da hélice se inicia a cerca de 0,54 a 0,56 nm de distância do anterior. Os grupos R nessa estrutura ficam voltados para o exterior da coluna cilíndrica, formada pelos átomos das ligações peptídicas e pelos Cα. A existência e a estabilidade da α-hélice é dependente, portanto, dos grupos R dos aminoácidos da estrutura primária. Aminoácidos adjacentes com grupos R carregados (como os aa ácidos Asp e Glu e os básicos Arg e Lys) dificultam essa estabilidade, pois tendem a se repelir e alterar os ângulos possíveis para garantir a estrutura. A prolina é outro exemplo de aminoácido que não permite a estrutura em α-hélice pelo fato de possuir grupo R ciclizado com o grupo amino, o que provoca “dobras” na estrutura espacial. O exemplo mais conhecido de proteína em α-hélice é o da α-queratina (presente nos pelos e unhas de mamíferos e nas garras e penas das aves). (p. 25, grifo meu).
A imagem aumenta a sua compreensão (p. 26):
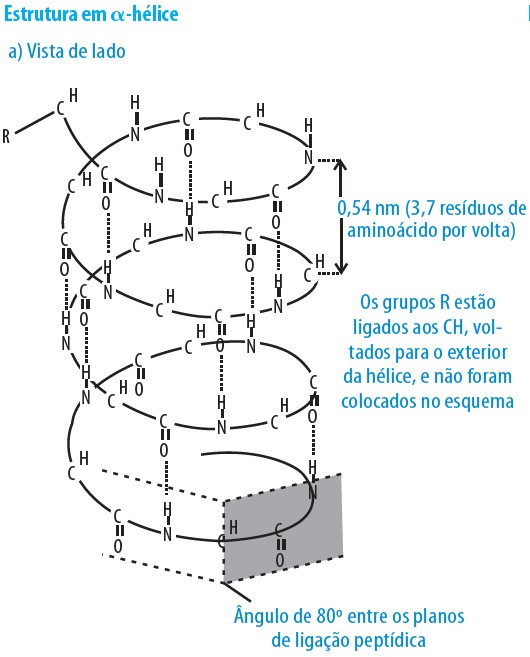
Referência: CARVALHO, H. F.; RECCO-PIMENTEL, S. M. A Célula. 4. ed. Barueri: Manole, 2019.
305) São propriedades físicas dos aminoácidos:
- A) substâncias sólidas, alto ponto de fusão e ebulição e insolúveis em solventes orgânicos
- B) colóides, alto ponto de fusão e ebulição e insolúveis em solventes orgânicos
- C) substâncias líquidas, baixo ponto de fusão e ebulição e insolúveis em solventes orgânicos
- D) substâncias líquidas, baixo ponto de fusão e ebulição e solúveis em água
A alternativa correta é letra A) substâncias sólidas, alto ponto de fusão e ebulição e insolúveis em solventes orgânicos.
Explicação:Os aminoácidos são as unidades básicas das proteínas e possuem propriedades físicas distintas que são importantes para sua função biológica. Eles são, de fato, substâncias sólidas em condições normais de temperatura e pressão, o que está relacionado à sua estrutura cristalina estável. Além disso, os aminoácidos têm pontos de fusão e ebulição relativamente altos, o que reflete as fortes interações entre suas moléculas, como ligações de hidrogênio e interações iônicas. Essas propriedades também contribuem para a sua insolubilidade em solventes orgânicos, uma vez que os aminoácidos são polares e, portanto, têm uma afinidade maior por solventes polares, como a água, do que por solventes orgânicos não polares.
Questão 306
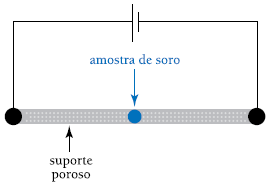
Sabe-se que:
– a carga elétrica de uma proteína depende do pH do meio em que está dissolvida;
– o ponto isoelétrico (pI) de uma proteína corresponde ao pH do meio onde ela é eletricamente neutra;
– quanto mais afastado do pH do meio for o ponto isoelétrico de uma proteína, maior será sua carga elétrica.
A tabela a seguir mostra os valores médios dos pontos isoelétricos e as velocidades de migração de quatro proteínas do soro sanguíneo, para essas condições experimentais:
pI
(valores médios)
gamaglobulina
betaglobulina
alfaglobulina
albumina
A ordem crescente das velocidades de migração das proteínas citadas é:
- A) v3 – v1 – v4 – v2
- B) v1 – v2 – v3 – v4
- C) v1 – v2 – v4 – v3
- D) v3 – v4 – v2 – v1
A alternativa correta é letra D) v3 – v4 – v2 – v1
GABARITO: LETRA D
Para determinar a ordem crescente das velocidades de migração das proteínas citadas, é necessário comparar os pontos isoelétricos das proteínas com o pH do meio de eletrólise (pH 6,0).
Gamaglobulina (v1): possui o pI mais elevado (8,0) em comparação às outras proteínas, o que significa que a sua carga elétrica será negativa em pH 6,0, atraindo-a em direção ao ânodo (polo positivo) e, consequentemente, tendo a maior velocidade de migração dentre as quatro proteínas.
Betaglobulina (v2): possui um pI (7,6) próximo ao pH do meio de eletrólise, o que significa que a sua carga elétrica não será tão elevada quanto a da gamaglobulina em pH 6,0, levando a uma velocidade de migração menor do que a desta proteína.
Alfaglobulina (v3): possui um pI (6,6) ainda mais próximo ao pH 6,0 do meio de eletrólise, resultando em uma carga elétrica menor do que a das outras proteínas. Assim, a velocidade de migração da alfaglobulina será menor do que a da gamaglobulina e da betaglobulina.
Albumina (v4): possui o pI mais baixo (4,8) dentre as proteínas citadas na questão, o que significa que em pH 6,0 terá uma carga elétrica positiva muito alta, atraindo-a em direção ao cátodo (polo negativo) e resultando em uma velocidade de migração menor do que as outras proteínas.
Portanto, a ordem crescente das velocidades de migração das proteínas citadas é v3 - v4 - v2 - v1, ou seja, a alfaglobulina tem a terceira maior velocidade de migração, seguida pela albumina, betaglobulina e, por fim, a gamaglobulina, que tem a maior velocidade de migração.
A alternativa correta é a letra d) v3 – v4 – v2 – v1
307) Ingerir proteínas não é o suficiente para evitar a má nutrição protéica; a taxa de aminoácidos essenciais deve atender às necessidades do organismo. A qualidade protéica está ligada a esta proporção de aminoácidos. Sendo assim, uma proteína é considerada de “alta qualidade” se atende às necessidades humanas de aminoácidos na proporção correta. Muitas dessas proteínas são de origem animal; as de origem vegetal precisam ser combinadas para que, no balanço protéico geral, essa necessidade seja suprida.
- A) a falta da quantidade mínima de calorias fornecida pelas proteínas causa dificuldades cognitivas que levam ao atraso escolar.
- B) a falta de alguns aminoácidos acarreta doenças carenciais como raquitismo e cegueira noturna.
- C) a produção de hormônios esteróides, tais como os sexuais, depende da quantidade de proteínas presentes.
- D) a carência de proteínas é mais grave em adultos, pois o crescimento do organismo fica muito comprometido.
- E) a má nutrição protéica pode ocasionar o aparecimento de doenças infecciosas, pois reduz a atividade imunológica.
A alternativa correta é letra E) a má nutrição protéica pode ocasionar o aparecimento de doenças infecciosas, pois reduz a atividade imunológica.
O balanço proteico geral é a proporção de aminoácidos essenciais que o organismo recebe a partir da dieta. Para evitar a má nutrição proteica, é importante que o balanço proteico geral seja positivo, ou seja, que o organismo receba mais aminoácidos essenciais do que necessita.
Esse balanço proteico geral deve ser atingido porque:
a) a falta da quantidade mínima de calorias fornecida pelas proteínas causa dificuldades cognitivas que levam ao atraso escolar.
INCORRETA: a falta de calorias pode causar problemas cognitivos, mas essa não é a razão principal para alcançar o balanço proteico, uma vez que as proteínas não são a principal fonte de energia para o organismo.
b) a falta de alguns aminoácidos acarreta doenças carenciais como raquitismo e cegueira noturna.
INCORRETA: A falta de alguns aminoácidos essenciais pode levar a doenças carenciais específicas, mas o raquitismo é causado pela deficiência de vitamina D, e a cegueira noturna é causada pela deficiência de vitamina A. Ambas as doenças são causadas por deficiências de micronutrientes do tipo vitamina, mas não de proteínas.
c) a produção de hormônios esteróides, tais como os sexuais, depende da quantidade de proteínas presentes.
INCORRETA: A produção de hormônios esteroides, tais como os sexuais, depende da presença de colesterol, logo, está relacionada à presença de lipídios, não diretamente à quantidade de proteínas.
d) a carência de proteínas é mais grave em adultos, pois o crescimento do organismo fica muito comprometido.
INCORRETA: carência de proteínas é grave em todas as fases da vida, mas é mais grave em crianças e adolescentes, pois o crescimento do organismo fica muito comprometido.
e) a má nutrição proteica pode ocasionar o aparecimento de doenças infecciosas, pois reduz a atividade imunológica.
CORRETA: A má nutrição protéica pode afetar adversamente o sistema imunológico de várias maneiras, pois as proteínas são essenciais para a síntese de anticorpos, enzimas e outras moléculas cruciais para o funcionamento adequado do sistema imunológico. Quando a ingestão de proteínas é insuficiente, a produção e a função desses componentes imunológicos podem ser comprometidas. Os anticorpos, por exemplo, são proteínas fundamentais para a defesa do organismo contra patógenos. A falta de aminoácidos essenciais provenientes de proteínas na dieta pode resultar na produção inadequada de anticorpos, reduzindo a eficácia da resposta imunológica. Além disso, as proteínas desempenham um papel vital na regulação das células do sistema imunológico, como linfócitos e macrófagos.
308) Acerca da estrutura de proteínas, assinale a opção correta.
- A) A hemoglobina apresenta quatro cadeias de polipeptídios do mesmo tipo, as cadeias alfa.
- B) A presença de forma primária das moléculas proteicas nas condições de pH e temperaturas existentes nos organismos vivos é denominada configuração nativa.
- C) Entre as forças de estabilização das moléculas de proteína estão as ligações peptídicas, que, se fossem as únicas, confeririam às moléculas proteicas maior regularidade nas dobras existentes em sua estrutura.
- D) As pontes de hidrogênio consistem nas ligações covalentes estabelecidas entre os resíduos do aminoácido cisteína.
- E) A organização das subunidades de proteína para configurar a sua molécula denomina-se estrutura quaternária da proteína.
309) Assinale a opção correta acerca do padrão de dobramento do domínio alfa e do domínio beta.
- A) Trata-se de um padrão de dobramento constituído de hélices alfa e hélices beta com proporções equilibradas.
- B) No padrão de dobramento alfa comum, as hélices se inclinam para que as cadeias laterais possam se tocar e estabelecer contato com o meio aquoso circundante.
- C) Os domínios beta são caracterizados pelo predomínio de cadeias paralelas, combinadas em duas folhas de cadeias alfa que se encostam e formam um sanduíche alfa.
- D) Como nas carboxipeptidases, há folhas beta abertas cujas fitas não seguem a ordem da sequência do peptídio.
- E) A folha beta aberta é mais comum nas proteínas fibrosas.
Resposta: A alternativa correta é a letra D.
Explicação: As folhas beta abertas são estruturas secundárias encontradas em proteínas onde as fitas beta não estão organizadas de maneira antiparalela ou paralela contínua. Em vez disso, elas são montadas de tal forma que as fitas individuais não seguem a ordem direta da sequência de aminoácidos do peptídeo. Isso é observado em carboxipeptidases, que são enzimas que catalisam a hidrólise da ligação peptídica do aminoácido terminal de uma cadeia polipeptídica. A estrutura aberta permite o acesso ao sítio ativo da enzima, facilitando a reação de clivagem do peptídeo.
310) Acerca da estabilidade das proteínas, assinale a opção correta.
- A) As ligações dissulfeto estabilizam a estrutura quaternária da proteína, pois se formam quando a proteína se dobra para adquirir sua posição nativa.
- B) Apesar de sua estabilidade alta, as proteínas estão sujeitas à alteração das forças fracas. Normalmente isso ocorre de forma brusca, comprometendo a estabilidade da estrutura restante.
- C) As proteínas hipertermófilas, assim como as mesófilas, desnaturam-se na mesma temperatura, em torno de 100 ºC.
- D) A maleabilidade das proteínas fibrosas, como a queratina, aumenta proporcionalmente ao aumento da quantidade de ligações cruzadas dissulfeto entre as protofibrilas.
- E) A estrutura quaternária de uma proteína compreende o arranjo espacial das subunidades polipeptídicas, as quais se organizam de modo geométrico específico.
A alternativa correta é letra E)
A estrutura quaternária de uma proteína é o nível mais alto de organização proteica e refere-se ao modo como as subunidades polipeptídicas se associam e se organizam em um complexo funcional. Cada subunidade é, em si, uma proteína completa, e a maneira como elas se arranjam no espaço é crucial para a função da proteína. Essas subunidades podem se organizar de maneira simétrica ou assimétrica, formando estruturas como dímeros, tetrâmeros, entre outros, dependendo do número de polipeptídeos envolvidos.
As ligações dissulfeto, mencionadas na opção A, são importantes para a estabilização das estruturas terciárias das proteínas, contribuindo para a manutenção da forma tridimensional de uma única cadeia polipeptídica, mas não são exclusivas da estrutura quaternária.
As proteínas hipertermófilas, citadas na opção C, são de fato mais resistentes a altas temperaturas quando comparadas às mesófilas, mas não desnaturam todas na mesma temperatura. A estabilidade térmica varia de acordo com a estrutura específica da proteína e seu ambiente.
Quanto à opção D, as ligações cruzadas dissulfeto podem aumentar a rigidez das proteínas fibrosas, como a queratina, mas isso não se traduz necessariamente em maior maleabilidade.
