Questões Sobre Biomoléculas e Bioquímica - Biologia - concurso
341) As proteínas são macromoléculas formadas por pequenas moléculas de aminoácidos, sendo as moléculas orgânicas as mais abundantes e importantes das células. Nos seres vivos, as proteínas têm como função
- A) o armazenamento de energia.
- B) a atuação como coenzima em reações anabólicas.
- C) a obstrução do reconhecimento entre as células.
- D) o provimento do suporte mecânico para células e tecidos.
A alternativa correta é letra D) o provimento do suporte mecânico para células e tecidos.
As proteínas são fundamentais para a estrutura e função das células. Elas desempenham um papel crucial na formação do citoesqueleto, que dá forma à célula e permite o movimento celular, além de compor a matriz extracelular, que fornece suporte e estrutura aos tecidos. As proteínas fibrosas, como o colágeno e a elastina, são exemplos de proteínas que proporcionam resistência e elasticidade aos tecidos conectivos. Portanto, a função das proteínas vai além do armazenamento de energia ou atuação como coenzimas; elas são essenciais para a integridade estrutural dos organismos vivos.
342) O ovo quando cozido altera a sua estrutura. Isto se deve
- A) à formação dos aminoácidos.
- B) à desnaturação das proteínas.
- C) aos centros ativos das proteínas.
- D) ao modelo chave-fechadura da enzima.
Resposta: B) à desnaturação das proteínas.
Explicação: Quando o ovo é cozido, o calor provoca a desnaturação das proteínas presentes na clara e na gema. Esse processo altera a estrutura tridimensional das proteínas, fazendo com que elas percam a sua conformação original e coagulem, o que resulta na mudança de estado físico do ovo de líquido para sólido. A desnaturação é um processo irreversível e não envolve a formação de novos aminoácidos, mas sim a alteração da estrutura das proteínas que já existem.
343) Proteínas são biomoléculas constituídas por uma ou mais cadeias de aminoácidos. No que se refere às características das proteínas, assinale a alternativa correta.
- A) A estrutura terciária é a conformação tridimensional de uma cadeia polipeptídica.
- B) Existem três níveis de estrutura proteica conhecidos.
- C) São formadas apenas por ligações covalentes.
- D) Diferentes sequências de aminoácidos formam proteínas semelhantes.
- E) Proteínas não podem ser quimicamente sintetizadas.
A alternativa correta é letra A) A estrutura terciária é a conformação tridimensional de uma cadeia polipeptídica.
a) A estrutura terciária é a conformação tridimensional de uma cadeia polipeptídica.
CORRETA: A estrutura terciária de uma proteína é a organização tridimensional específica da cadeia polipeptídica como um todo. A estrutura terciária resulta das interações complexas entre os resíduos de aminoácidos na cadeia polipeptídica, incluindo ligações covalentes, como as pontes dissulfeto entre os resíduos de cisteína, e uma variedade de interações não covalentes, como ligações de hidrogênio, interações hidrofóbicas e interações iônicas.
b) Existem três níveis de estrutura proteica conhecidos.
INCORRETA: Essa afirmação é incorreta, pois na verdade existem quatro níveis principais de estrutura em uma proteína: primária, secundária, terciária e quaternária.
c) São formadas apenas por ligações covalentes.
INCORRETA: As proteínas são formadas por uma variedade de interações, tanto covalentes quanto não covalentes. Embora as ligações covalentes sejam importantes na estrutura das proteínas, como as ligações peptídicas que unem os aminoácidos na cadeia polipeptídica, as proteínas também dependem fortemente de interações não covalentes para manter sua estrutura e função, como ligações de hidrogênio, interações iônicas.
d) Diferentes sequências de aminoácidos formam proteínas semelhantes.
INCORRETA: Cada proteína tem uma sequência específica e única de aminoácidos, determinada pela sequência de nucleotídeos no DNA que codifica essa proteína. Essa sequência de aminoácidos influencia a maneira como a proteína se dobra e interage com outras moléculas, afetando diretamente sua função biológica. Portanto, diferentes sequências de aminoácidos geralmente resultam em proteínas com estruturas e funções distintas, e não em proteínas semelhantes.
e) Proteínas não podem ser quimicamente sintetizadas.
INCORRETA: Existem várias técnicas que permitem a síntese de proteínas em laboratório, incluindo a síntese peptídica, que é o processo de ligação de aminoácidos em uma sequência específica para formar um polipeptídeo. Um exemplo ocorre na engenharia genética e na biotecnologia, que permitem a produção de proteínas recombinantes em organismos geneticamente modificados, como bactérias, leveduras ou células de mamíferos, que podem produzir grandes quantidades de proteínas específicas para uso em pesquisa científica, medicina, indústria alimentícia, entre outros campos.
344) O aminoácido estruturalmente mais simples (glicina, H2NCHCOOH) apresenta duas dissociações de próton e o ponto isoelétrico em pH= 6,06 (meio aquoso a 25 °C). A partir desse quadro, em relação à glicina, é correto afirmar que:
- A) em pH = 6,06, o grupo carboxila está completamente dissociado e o amino está completamente protonado.
- B) uma solução aquosa preparada através da solubilização da glicina neutra, sem a adição de ácidos ou bases, tem o pH do ponto isoelétrico.
- C) no ponto isoelétrico, as espécies de glicina em solução estão sob a forma da molécula neutra H2NCHCOOH.
- D) em valores de pH logo acima do ponto isoelétrico, as espécies de glicina em solução apresentam carga total negativa.
- E) no ponto isoelétrico, a concentração da espécie catiônica [H3NCHCOOH]+ é igual a da aniônica [H2NCHCOO] –.
Resposta: A alternativa correta é a letra B).
Explicação: No ponto isoelétrico, o pH é igual ao pI (ponto isoelétrico) da molécula, o que significa que a molécula não tem carga líquida. Para a glicina, o ponto isoelétrico é pH 6,06. Neste pH, a glicina existe principalmente na forma zwitteriônica, onde o grupo carboxila (-COOH) perde um próton e se torna -COO- (forma aniónica) e o grupo amino (-NH2) ganha um próton e se torna -NH3+ (forma catiónica). Portanto, a glicina está em equilíbrio entre suas formas catiónica e aniónica, resultando em uma molécula globalmente neutra.
As outras alternativas estão incorretas porque:
- A alternativa A) está incorreta porque em pH = 6,06, o grupo carboxila não está completamente dissociado.
- A alternativa C) está incorreta porque no ponto isoelétrico, a glicina não está sob a forma da molécula neutra H2NCHCOOH, mas sim como um zwitteríon.
- A alternativa D) está incorreta porque em valores de pH logo acima do ponto isoelétrico, a glicina não apresenta carga total negativa, mas começa a adquirir uma carga negativa à medida que o pH aumenta.
- A alternativa E) está incorreta porque no ponto isoelétrico, a concentração das espécies catiónica e aniónica não são iguais; a molécula está na forma zwitteriônica.
345) Leia o trecho a seguir e assinale a alternativa correta:
- A) Uma proteína, anemia falciforme, obriga.
- B) Uma proteína, doença celíaca, obriga.
- C) Um carboidrato, anemia falciforme, recomenda.
- D) Uma proteína, doença celíaca, recomenda.
A alternativa correta é letra B) Uma proteína, doença celíaca, obriga.
Gabarito da banca: Letra "B"
Entendimento: Letra "B"
Acompanhe minha análise:
a) Uma proteína, anemia falciforme, obriga.
ERRADA.
b) Uma proteína, doença celíaca, obriga.
CORRETA.
A introdução de cereais contendo glúten na alimentação humana data cerca de 10.000 anos atrás, no sudoeste da Ásia . Trigo, centeio e cevada, juntamente com o milho e o arroz, representam os cereais mais consumidos no mundo. Observa-se, entretanto, uma substituição progressiva do consumo de cereais como arroz e milho pelo de trigo, até mesmo em países do Norte da África e Ásia. Isto pode ser parcialmente explicado pelo fato de o trigo se adaptar às diversas condições climáticas, assim como pela ocidentalização da alimentação observada em muitos países.
Com o advento da agricultura e posterior industrialização, ocorreram importantes alterações nos padrões da alimentação, seja pela difusão ampla da dieta mediterrânea, principalmente nos países europeus, permitindo a incorporação dos cereais em quantidades ainda maiores na dieta, seja pela indústria alimentícia que utiliza principalmente o trigo no processamento dos alimentos. Isto porque o glúten proveniente principalmente do trigo confere às farinhas as propriedades de coesão e viscoelasticidade necessárias para o preparo de alimentos como pães, bolos, massas, biscoitos e até mesmo de medicamentos. Nos dias atuais, o glúten provê até 50% do valor energético consumido em países desenvolvidos e em desenvolvimento. (p. 1049, grifo meu).
Referência: COZZOLINO, S. M. F. Biodisponibilidade de Nutrientes. 5. ed. rev. e atual. Barueri, SP : Manole, 2016.
Existem uma série de desordens relacionadas ao glúten (p. 70):
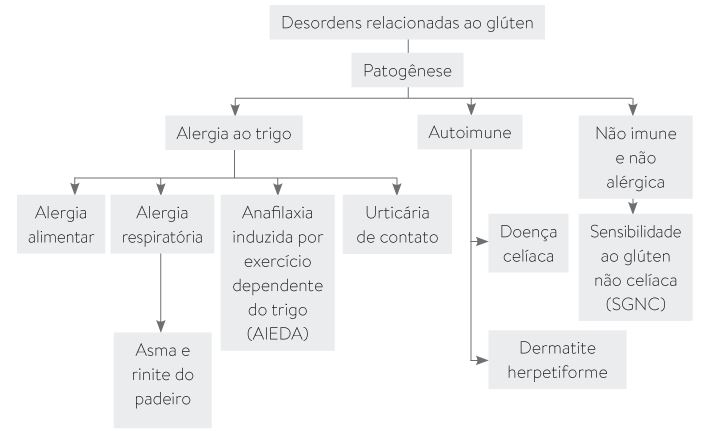
Referência: YONAMINE, GL H.; PINOTTI, R. Alergia Alimentar: alimentação, nutrição e terapia nutricional. 1. ed. Barueri : Manole, 2021.
c) Um carboidrato, anemia falciforme, recomenda.
ERRADA.
d) Uma proteína, doença celíaca, recomenda.
ERRADA.
346) A encefalopatia espongiforme bovina, também conhecida como “doença da vaca louca”, é provocada por uma forma alterada de proteína que se torna infectante. Essa proteína gera agregados extracelulares no tecido nervoso, o que acaba por romper o tecido ao redor. Assinale a alternativa que apresenta o nome deste tipo de proteína modificada.
- A) Amnion.
- B) Códon.
- C) Príon.
- D) Cátion.
A alternativa correta é letra C) Príon.
Gabarito da banca: Letra "C"
Entendimento: Letra "C"
Acompanhe minha análise:
a) Amnion.
ERRADA.
b) Códon.
ERRADA.
c) Príon.
CORRETA. Anote aí:
Uma lição importante dos viroides é que uma única molécula pode ser o agente infeccioso a disseminar uma doença. No entanto, os viroides são ácidos nucleicos, cuja habilidade de se replicar é bem conhecida. Ainda mais surpreendentes são as evidências da existência de proteínas infecciosas, denominadas príons, que parecem causar inúmeras doenças cerebrais degenerativas em varias espécies animais. Essas doenças incluem a scrapie em ovinos (um tipo de encefalopatia espongiforme transmissível); a doença da vaca louca, que flagelou a indústria de carne europeia há poucos anos; e a doença de Creutzfeldt-Jakob no ser humano, que causou a morte de 150 pessoas na Grã Bretanha. É provável que os príons sejam transmitidos nos alimentos, como pode ocorrer quando as pessoas se alimentam de carne de gado com vaca louca contendo príons. O kuru, outra doença causada por príons, foi identificada no início da década de 1990 entre os nativos de South Fore da Nova Guiné. Uma epidemia de kuru ocorreu na década de 1960, desafiando os cientistas, que inicialmente acreditavam que a doença possuía um componente genético. Entretanto, com o tempo, as investigações antropológicas revelaram como a doença se disseminava: rituais canibalistas, prática comum entre os nativos de South Fore naquela época.
Duas características dos príons são particularmente alarmantes. Primeiro, os príons atuam silenciosamente, com um período de incubação de pelo menos dez anos antes do desenvolvimento dos sintomas. O extenso período de incubação impede a identificação das fontes de infecções, a qual ocorre muito depois do aparecimento dos primeiros casos. Segundo, os príons são praticamente indestrutíveis. Não são destruídos nem desativados pelo aquecimento em temperaturas normais de cozimento. Até hoje, não há cura conhecida para as doenças causadas por príons e a única esperança para o desenvolvimento de tratamentos eficazes reside no entendimento do processo de infecção. (p. 405, grifo meu).
Referência: REECE, J. B. et al. Biologia de Campbell. 10. ed. Porto Alegre: Artmed, 2015.
d) Cátion.
ERRADA.
Questão 347
triangle = hv\rf omega varnothing = gamma varnothing ( 1 – sigma)\m=(2l + 1)\h=constante,de,Planck=6,626×10^{-34} J.s\K=constante,de,Boltzman,1,38.10^{-23} J/K\v= frequência\ gamma,do, {}^1 H = 42,59MHz/T\N_{-1/2}/ N_{+1/2} = e^{ triangle E/KT sim 1}
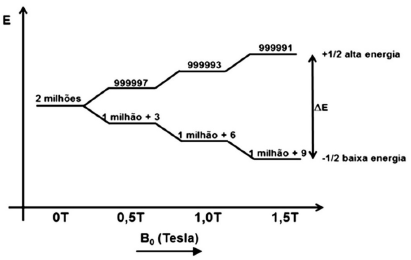
Os processos de relaxação compreendem os métodos pelos quais núcleos excitados retornam ao seu estado estável e pelos quais o equilíbrio de Boltzmann é reestabelecido. Polissacarídeos possuem, em geral, propriedades relacionadas à relaxação que são semelhantes a qual classe de compostos?
- A) Lipídeos.
- B) Proteínas.
- C) Polióis.
- D) Esteróis.
- E) Aromáticos
Resposta: A alternativa correta é letra B) Proteínas.
Explicação: Os polissacarídeos, como o glicogênio e o amido, são grandes moléculas de armazenamento de energia que possuem uma estrutura altamente ramificada. Essa estrutura permite que eles sejam rapidamente hidrolisados quando necessário, liberando glicose para fornecer energia. Esse processo de hidrólise e liberação de energia está relacionado ao conceito de relaxação, onde a molécula retorna a um estado de menor energia após ter sido 'excitada' ou energizada.
As proteínas, especialmente aquelas que atuam como enzimas, também passam por um processo semelhante durante sua atuação no corpo. Elas podem mudar de forma quando se ligam a substratos, e depois retornam ao seu estado original após a reação. Esse ciclo de mudança de forma e retorno ao estado original é análogo ao processo de relaxação descrito na questão, fazendo com que as proteínas sejam a classe de compostos mais semelhante aos polissacarídeos nesse aspecto.
348)
- A) Interações hidrofóbicas e eletrostáticas, ligações covalentes, pontes de hidrogênio e forças de Van der Waals são exemplos de interações entre cadeias laterais que estabilizam proteínas que apresentem o tipo de estrutura ilustrado na letra C.
- B) Proteínas multiméricas, constituídas pela estrutura ilustrada na letra D, são formadas por multissubunidades que dificultam a abertura e o fechamento de cavidades na superfície da molécula proteica.
- C) Supondo que uma proteína seja constituída pela estrutura representada na letra A, é correto afirmar que o número de aminoácidos, pouco variável, deverá facilitar as trocas de um aminoácido por outro sem que a atividade proteica seja afetada.
- D) Uma proteína com a estrutura representada na letra B deverá ser constituída de ligações covalentes, que promovem a estabilização dessa proteína.
- E) Se a estrutura da proteína ilustrada na letra C for submetida à ação de um agente físico desnaturante, como calor, luz ou frio, haverá perda de aminoácidos e, consequentemente, de toda a estrutura primária que estava presente.
A alternativa correta é letra A) Interações hidrofóbicas e eletrostáticas, ligações covalentes, pontes de hidrogênio e forças de Van der Waals são exemplos de interações entre cadeias laterais que estabilizam proteínas que apresentem o tipo de estrutura ilustrado na letra C.
Gabarito: Letra A.
a) Interações hidrofóbicas e eletrostáticas, ligações covalentes, pontes de hidrogênio e forças de Van der Waals são exemplos de interações entre cadeias laterais que estabilizam proteínas que apresentem o tipo de estrutura ilustrado na letra C.
Os níveis de organização na estrutura das proteínas representados na figura são: A= estrutura primária; B= estrutura secundária; C= estrutura terciária; e D= estrutura quaternária. Essa alternativa trata das ligações envolvidas no tipo de estrutura ilustrado na letra C, portanto, refere-se à estrutura terciária.
A estrutura terciária pode ser entendida como a estrutura tridimensional de uma proteína, essa estrutura é resultante das interações entre os grupos R dos aminoácidos que compõem essa proteína. Entre as interações citadas na alternativa, a maioria são do tipo não covalente (ligações mais fracas) como as interações hidrofóbicas, interações eletrostáticas, pontes de hidrogênio e forças de Van der Waals. Sobre a ligação covalente (mais forte) que participa da formação da estrutura terciária das proteínas, podemos destacar a ligação dissulfeto que ocorre entre moléculas de enxofre. Abaixo um resumo das principais características das ligações não covalentes que foram citadas e ao final a estrutura geral dos aminoácidos:
- Interações hidrofóbicas: nesse tipo de interação os aminoácidos, de grupos hidrofóbicos R, se unem e formam uma região hidrofóbica na parte interna da proteína e uma região hidrofílica na parte externa dessa.
- Interações eletrostáticas (ligações iônicas): essa interação ocorre entre grupos R com cargas opostas, ou seja, um grupo R com carga positiva e outro com carga negativa.
- Pontes de hidrogênio: ocorre entre o oxigênio do grupo carboxila de um aminoácido e o hidrogênio do grupo amino de outro.
- Forças de Van der Waals: refere-se à força de atração entre moléculas, excluindo-se àquelas relacionadas a ligações covalentes ou interações eletrostáticas. Pode ser de três tipos: 1° - interação entre dois dipolos permanentes (Força de Keesom); 2° - interação entre um dipolo permanente e um polo induzido (Força de Debye); 3° interação entre dois dipolos instantaneamente induzidos (Força de dispersão London).
- Estrutura geral de um aminoácido: carbono alfa ligado a um átomo de hidrogênio, um grupo amino, um grupo carboxila e um grupo R (variável).
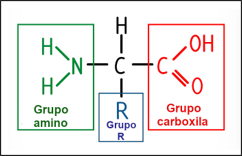
Fonte da imagem: https://static.mundoeducacao.uol.com.br/mundoeducacao/2020/12/estrutura-do-aminoacido.jpg. Acesso em 17/01/22.
Análise da demais alternativas:
b) Proteínas multiméricas, constituídas pela estrutura ilustrada na letra D, são formadas por multissubunidades que dificultam a abertura e o fechamento de cavidades na superfície da molécula proteica.
INCORRETA.
As multissubunidades permitem que ocorra uma rápida abertura e fechamento de cavidades na superfície da molécula proteica, na maioria dos casos esses processos estão relacionados com a função da proteína, portanto, as multissubunidades não podem dificultá-los.
c) Supondo que uma proteína seja constituída pela estrutura representada na letra A, é correto afirmar que o número de aminoácidos, pouco variável, deverá facilitar as trocas de um aminoácido por outro sem que a atividade proteica seja afetada.
INCORRETA.
A estrutura representada na letra A é a estrutura primária, essa corresponde a sequência linear dos aminoácidos, unidos por meio de ligações peptídicas. A troca de um aminoácido por outro pode alterar a atividade proteica, podemos citar como exemplo a anemia falciforme, uma doença hereditária que afeta as hemácias, que ocorre devido a alteração de um único aminoácido.
d) Uma proteína com a estrutura representada na letra B deverá ser constituída de ligações covalentes, que promovem a estabilização dessa proteína.
INCORRETA.
A estrutura representada na letra B é a estrutura secundária, sendo os dois tipos mais comuns, α-hélice e a folha-β pregueada, mantidas por meio de ligações de hidrogênio, um tipo de ligação não covalente.
e) Se a estrutura da proteína ilustrada na letra C for submetida à ação de um agente físico desnaturante, como calor, luz ou frio, haverá perda de aminoácidos e, consequentemente, de toda a estrutura primária que estava presente.
INCORRETA.
A desnaturação promove a alteração na estrutura tridimensional da proteína, afetando sua atividade. Entretanto, a desnaturação não promove a perda de aminoácidos, ou seja, a estrutura primária é mantida.
349) O que é um Prion?
- A) Bactéria altamente contaminante.
- B) Partículas proteicas infectantes modificadas, que se distinguem de vírus e bactérias comuns por serem desprovidas de cargas genética e apresentam resistência à ação das proteases.
- C) Proteínas não modificadas infectantes, que não são nem vírus e nem bactérias e que causam doenças.
- D) Moléculas proteicas com propriedade não infectante, funcionando no organismo como uma defesa.
- E) Proteínas modificadas que não causam doença e que carregam cargas genéticas no seu interior.
A alternativa correta é letra D) Moléculas proteicas com propriedade não infectante, funcionando no organismo como uma defesa.
Gabarito: Alternativa D
Gabarito do professor: Alternativa B
Justificativa: Os príons consistem em proteínas defeituosas, com caráter altamente infeccioso e desprovidas de material genético. Quando em contato com o organismo, costumam afetar o sistema nervoso acarretando em doenças degenerativas em decorrência da destruição do tecido cerebral, tornando-o com aspecto esponjoso de forma progressiva, até levar o indivíduo a morte.
A forma mais comum de príon e mais conhecida é a encefalopatia espongiforme bovina (EEB), no qual é popularmente conhecida como doença da vaca-louca, que acomete gados. Essa mesmo proteína pode acometer humanos, principalmente com o consumo de carne infectada mal cozida, ocasionando a doença de Creutzfeldt-Jakob. Outras formas de doenças causadas por príons que ocorrem em humanos são: Síndrome de Gerstmann-Sträussler-Scheinker (GSS), Insônia fatal familiar (FFI) e Kuru.
350) Dentre as biomoléculas que compõem os organismos vivos, as proteínas se destacam pela sua complexidade estrutural e funcional. A conformação de uma proteína é fundamental para a função que ela exerce. Para manter suas estruturas em níveis terciário e quaternário, são necessárias ligações não covalentes e covalentes, exemplificadas, respectivamente, pelas seguintes ligações:
- A) de dissulfeto e peptídicas
- B) peptídicas e de dissulfeto
- C) de pontes de hidrogênio e de dissulfeto
- D) de dissulfeto e de pontes de hidrogênio
Alternativa C) de pontes de hidrogênio e de dissulfeto
As proteínas são macromoléculas essenciais para a vida, com diversas funções biológicas. A estrutura tridimensional de uma proteína é determinante para sua função. Essa estrutura é mantida por diferentes tipos de ligações:
- Ligações de pontes de hidrogênio: São ligações não covalentes importantes para estabilizar as estruturas secundária, terciária e quaternária das proteínas. Elas ocorrem entre um átomo de hidrogênio ligado a um átomo eletronegativo (como oxigênio ou nitrogênio) e outro átomo eletronegativo.
- Ligações dissulfeto: São ligações covalentes fortes formadas entre dois átomos de enxofre de dois resíduos de cisteína. Essas ligações são cruciais para a estabilidade da estrutura terciária e quaternária das proteínas, especialmente em ambientes extracelulares.
Portanto, a alternativa C é correta, pois as pontes de hidrogênio e as ligações dissulfeto são exemplos de ligações não covalentes e covalentes, respectivamente, que contribuem para a conformação e estabilidade das estruturas de nível superior das proteínas.
