Questões Sobre Biomoléculas e Bioquímica - Biologia - concurso
371) No que diz respeito à estrutura tridimensional das proteínas, analise as afirmativas abaixo.
- A) Estão corretas todas as afirmativas
- B) Estão corretas apenas as afirmativas I e II
- C) Estão corretas apenas as afirmativas II e III
- D) Estão corretas apenas as afirmativas I e III
- E) Nenhuma das afirmativas está correta
A alternativa correta é letra C) Estão corretas apenas as afirmativas II e III
I. O caráter planar do grupo peptídico não limita a flexibilidade conformacional da cadeia polipeptídica.
INCORRETA: O caráter planar do grupo peptídico influencia a flexibilidade conformacional da cadeia polipeptídica. O grupo peptídico possui uma configuração planar fixa e rígida, o que restringe algumas conformações da cadeia. São realizadas movimentos de rotação apenas ao redor do carbono alfa de cada resíduo do aminoácido.
II. As proteínas fibrosas contêm longos trechos de estruturas secundárias regulares.
CORRETA: As proteínas fibrosas são caracterizadas por longos trechos de estruturas secundárias regulares, como hélices alfa ou folhas beta, que se repetem ao longo da cadeia polipeptídica. Essas proteínas têm uma forma alongada e são muitas vezes envolvidas na formação de fibras ou filamentos, como no caso do colágeno ou da queratina.
III. Nem todos os segmentos polipeptídicos formam estruturas secundárias regulares.
CORRETA: Algumas regiões da cadeia polipeptídica podem ser mais flexíveis e formar estruturas mais irregulares, como as estruturas em alça (loop), voltas beta (beta-turn) ou estruturas aleatórias (coil). Essas regiões irregulares são importantes para a conformação geral da proteína e podem ser responsáveis por sua função específica.
Somente a afirmativa I está incorreta, enquanto as demais são corretas.
Portanto, a alternativa que apresenta a resposta CORRETA é a letra c) Estão corretas apenas as afirmativas II e III.
372) Uma molécula de proteína é formada pela união de aminoácidos, que apresentam em sua estrutura um grupamento amina, um carboxila e um radical, representado pela letra R, que diferencia um aminoácido do outro. Esse radical tanto pode ser uma cadeia de carbono, quanto um simples átomo de
- A) ferro.
- B) oxigênio.
- C) nitrogênio.
- D) hidrogênio.
A alternativa correta é letra D) hidrogênio.
Gabarito: Letra D
A estrutura geral dos aminoácidos é composta por 01 (um) carbono central, denominado carbono alfa ou carbono quiral, o qual se encontra ligado a 04 (quatro) quatro grupos, a saber:
- Átomo de hidrogênio (H)
- Grupo carboxila (COO-)
- Grupo amino (NH3+)
- Grupo R: ou cadeia lateral, porção variável em estrutura, tamanho e carga elétrica entre os aminoácidos, influenciando em suas solubilidades em água. O grupo R pode ser uma cadeia carbônica (ex: aminoácido alanina, o grupo R corresponde ao metil (CH3)) ou um simples átomo de hidrogênio (ex: aminoácido glicina).
Para que a estrutura dos aminoácidos fique mais clara, observe a figura abaixo:
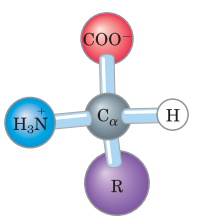
Portanto, o radical tanto pode ser uma cadeia de carbono quanto um simples átomo de hidrogênio (Gabarito: letra D).
--
Referências:
1) Nelson, D. L.; Cox, M.M. Princípios de Bioquímica de Lehninger. 6ª Edição. Porto Alegre: Artmed, 2014. 1220p.
373) “Proteína globular encontrada no interior dos eritrócitos, responsável pela coloração vermelha do sangue. Sua principal função é transportar oxigênio dos pulmões para os tecidos e dióxido de carbono dos tecidos para os pulmões. Além disso, é responsável pelo equilíbrio ácido-base no tecido sanguíneo. Distúrbios hereditários podem causar certas doenças relacionadas a esta proteína, por exemplo, a anemia falciforme e a talassemia.” Trata-se de:
- A) Timina.
- B) Hipófise.
- C) Hemoglobina.
- D) Adenosina trifosfato.
A alternativa correta é letra C) Hemoglobina.
A hemoglobina é uma proteína globular complexa, composta por quatro subunidades, cada uma contendo um grupo heme que se liga ao oxigênio. Ela é essencial para o transporte de oxigênio no sangue, pois se liga ao oxigênio nos pulmões e o libera nos tecidos que necessitam. Além disso, a hemoglobina também transporta parte do dióxido de carbono produzido pelos tecidos de volta aos pulmões para ser exalado. O equilíbrio ácido-base é mantido pela hemoglobina através do tamponamento do pH do sangue. Distúrbios na estrutura ou produção da hemoglobina podem levar a doenças como anemia falciforme, onde a hemoglobina é malformada, e talassemia, onde a produção de hemoglobina é insuficiente.
374)
- A) pentaternária
- B) quaternária
- C) terciária
- D) secundária
- E) primária
A alternativa correta é letra D) secundária.
Explicação:
As estruturas de proteínas são organizadas em quatro níveis de complexidade: primária, secundária, terciária e quaternária. A estrutura primária refere-se à sequência linear de aminoácidos na proteína. A estrutura secundária, que é a resposta correta para esta questão, inclui arranjos locais de aminoácidos formando configurações como alfa-hélices e folhas beta-pregueadas. Essas estruturas são estabilizadas por ligações de hidrogênio entre os átomos da cadeia principal. A estrutura terciária é a forma tridimensional completa da cadeia polipeptídica, e a quaternária refere-se à associação de várias cadeias polipeptídicas em um complexo funcional.
375) Sobre proteínas que foram desnaturadas sob condições de elevadas temperaturas, é correto afirmar que
- A) tiveram sua estrutura primária rompida irreversivelmente.
- B) apesar de modificadas, permaneceram com sua estrutura primária, composta pela sequência de aminoácidos ligados entre si.
- C) foram temporariamente modificadas, podendo assumir sua conformação espacial original em condições ideais de temperatura.
- D) se tornaram inadequadas para o consumo humano, já que foram estruturalmente alteradas.
A alternativa correta é letra B) apesar de modificadas, permaneceram com sua estrutura primária, composta pela sequência de aminoácidos ligados entre si.
Sobre proteínas que foram desnaturadas sob condições de elevadas temperaturas:
a) tiveram sua estrutura primária rompida irreversivelmente.
INCORRETA: A estrutura primária (linear) de uma proteína é definida pela cadeia de RNAm que foi traduzida, portanto, não é alterada pela desanturação. O que se altera é a conformação (após os dobramentos e ativação).
b) apesar de modificadas, permaneceram com sua estrutura primária, composta pela sequência de aminoácidos ligados entre si.
CORRETA: A desnaturação não altera a sequência de aminoácidos de uma proteína, pois essa sequência é determinada pela cadeia de RNAm que fora traduzida. A desnaturação resulta na quebra das ligações químicas que altera a conformação da molécula, que pode perder as estruturas secundária, terciária e quaternária para primária. Lembrando que essa perda da conformação resulta na perda da função pela proteína.
c) foram temporariamente modificadas, podendo assumir sua conformação espacial original em condições ideais de temperatura.
INCORRETA: Quando uma proteína é desnaturada por calor ou por agentes químicos, ela pode em alguns casos retornar para a sua conformação funcional quando o agente desnaturante é removido. Mas nem sempre! Em alguns casos, isso não é possível: por exemplo, um ovo frito não voltará a ser líquido quando colocado de volta na geladeira.
d) se tornaram inadequadas para o consumo humano, já que foram estruturalmente alteradas
INCORRETA: Um ovo frito é um exemplo de alimento que possui proteínas desnaturadas (por isso a clara muda de cor e volume) e que pode ser consumido.
376) Uma proteína de 40 aminoácidos sofreu desnaturação após ter sido exposta a uma alta concentração de ureia. Em seguida, a ureia foi retirada e a proteína retornou ao estado original de conformação enovelada, permitindo que as cadeias laterais de leucina e valina se agrupassem no interior dessa proteína. A explicação para esse fato é que
- A) a proteína estava em meio aquoso, e as cadeias laterais dos aminoácidos são hidrofóbicas.
- B) a retirada da ureia permitiu a recomposição das ligações peptídicas entre os aminoácidos.
- C) as cadeias laterais dos aminoácidos formaram ligações iônicas com a porção N-terminal da proteína.
- D) as ligações duplas entre os carbonos da cadeia principal dos aminoácidos promoveram o reenovelamento da proteína.
- E) as cadeias laterais desses aminoácidos formaram ligações covalentes entre si.
A alternativa correta é letra A) a proteína estava em meio aquoso, e as cadeias laterais dos aminoácidos são hidrofóbicas.
Gabarito: Letra A
Os aminoácidos Leucina e Valina são apolares, propriedade permite interações hidrofóbicas que influenciam na estrutura terciária de uma proteína, estando dispostos no interior de proteínas que se encontram em ambiente aquoso.
A Uréia (CH4N2O) atua como agente desnaturante, prejudicando as interações hidrofóbicas e desorganizando as estruturas secundária e terciária das proteínas (sem hidrolisar as ligações peptídicas, não alterando a estrutura primária). Com a remoção da uréia, a proteína retoma sua estrutura original, posicionando cadeias laterais hidrofóbicas no interior da estrutura e cadeias laterais hidrofílicas no exterior (meio aquoso).
Portanto, a proteína estava em meio aquoso, e as cadeias laterais dos aminoácidos são hidrofóbicas.
377) As proteínas exercem várias funções nos organismos vivos, como hormonal, catalítica, estrutural, nutritiva, entre outras. Devido a sua grande importância, os organismos necessitam obter, por meio de sua dieta, os aminoácidos necessários para a síntese proteica.
- A) parte dos aminoácidos essenciais necessários à formação das proteínas.
- B) a maioria dos aminoácidos não essenciais à formação das proteínas.
- C) todos dos aminoácidos essenciais necessários à formação das proteínas.
- D) todos os aminoácidos não essenciais à formação das proteínas.
A alternativa correta é letra C) todos dos aminoácidos essenciais necessários à formação das proteínas.
GABARITO LETRA C
c) todos dos aminoácidos essenciais necessários à formação das proteínas.
Para o metabolismo humano, há duas grandes divisões no conjunto de aminoácidos: os essenciais e os não essenciais. Os essenciais são aqueles que nosso corpo não consegue sintetizar e, portanto, precisa obrigatoriamente obter da alimentação. São essenciais os aminoácidos: isoleucina, leucina, lisina, metionina, fenilalanina, treonina, triptofano, histidina e valina
O feijão possui todos os aminoácidos essenciais;sendo que destes possui em maior quantidade a leucina, seguida pela lisina, fenilalanina, valina, isoleucina, treonina, histidina e metionina.Contudo os aminoácidos sulfurados – metionina e cisteína - aparecem em baixas concentrações (Ribeiro, N.D. et. al; Composição de aminoácidos de cultivares de feijão e aplicações para o melhoramento genético; 2007 <http://www.scielo.br/pdf/pab/v42n10/a04v4210.pdf>).
Vale fazer uma pequena observação aqui quanto à cisteína. Muito embora não esteja agrupada como aminoácido essencial, ainda assim ela é classificada como essencial-condicional, ou seja, para organismos jovens, em crescimento ou sofrendo de alguma patologia, é necessária uma complementação dietética para que este aminoácido atinja concentrações adequadas ao crescimento/desenvolvimento/recuperação (Princípios de Bioquímica de Lehninger - 6ª Edição - Michael M. Cox, pág 709).
O arroz, por sua vez, tem pouca lisina, mas apresenta concentrações maiores de aspartato, glutamato, metionina e cisteína. Consequentemente, a combinação arroz+feijão fornece ao organismo humano todos os aminoácidos essenciais em quantidades adequadas para o crescimento e desenvolvimento, por isso a resposta é a alternativa C. Observe a tabela abaixo:
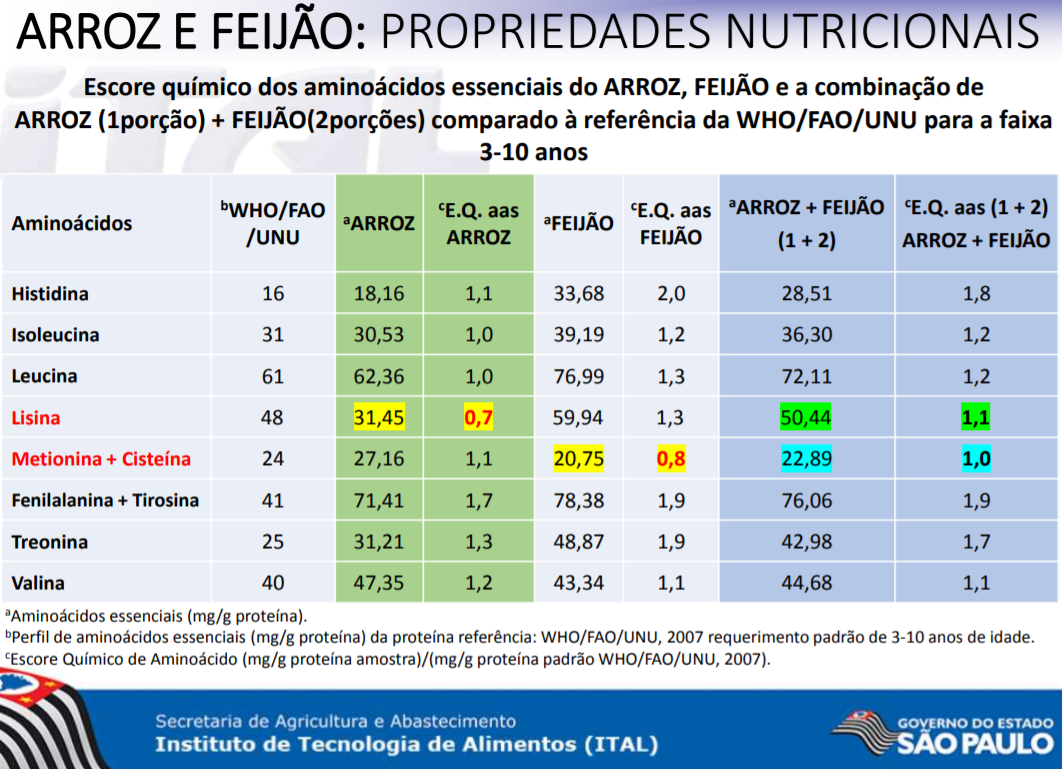
Fonte: http://www.agricultura.gov.br/assuntos/camaras-setoriais-tematicas/documentos/camaras-setoriais/feijao/2017/36a-ro/app_arroz_feijao_36ro_feijao.pdf
a) parte dos aminoácidos essenciais necessários à formação das proteínas. ERRADA
Se a combinação arroz+feijão fornece apenas parte dos aminoácidos essenciais, o indivíduo ainda precisaria de outras fontes alimentares complementares. Como o organismo não produz aminoácidos essenciais, uma dieta deficiente em algum(ns) dele(s) pode ocasionar problemas de crescimento e desenvolvimento.
b) a maioria dos aminoácidos não essenciais à formação das proteínas. ERRADA
Muito embora a ingestão de aminoácidos não essenciais também possa ser benéfica, ela não precisa abarcar todos os tipos de aminoácidos não essenciais na quantidade adequada, como ocorre com à ingestão dos aminoácidos essenciais. Isto porque o corpo é capaz de sintetizar qualquer um dos aminoácidos não essenciais a partir do esqueleto de algum dos outros. Logo, o que é importante aqui é a ingestão adequada da quantidade de nutrientes que sejam fontes de nitrogênio para o corpo; não é necessário a ingestão de cada um dos tipos de aminoácidos não essenciais.
Sendo assim, se a combinação arroz+feijão apenas trouxesse aminoácidos não essenciais, ainda que isso seja importante também, não seria suficiente para o crescimento e desenvolvimento de um organismo humano, o qual necessitada impreterivelmente dos aminoácidos essenciais.
d) todos os aminoácidos não essenciais à formação das proteínas. ERRADA
Esta alternativa incorre no mesmo erro da alternativa B. Os aminoácidos não essenciais podem ter a sua importância, mas sozinhos não garantem o desenvolvimento adequado do organismo. Por mais que você consuma todos os aminoácidos não essenciais, o déficit em algum dos aminoácidos essenciais traz prejuízos à saúde.
378) Marque a alternativa que apresenta uma ligação peptídica.
- A) Carboxila de um aminoácido e o grupo carboxila do outro
- B) Carboxila de um aminoácido e o grupo amina do outro
- C) Amina de um aminoácido e o grupo amina do outro
- D) Amina de um aminoácido e o radical R de outro
Resposta: A alternativa correta é letra B) Carboxila de um aminoácido e o grupo amina do outro.
Explicação: Uma ligação peptídica é uma ligação covalente que se forma entre o grupo carboxila de um aminoácido e o grupo amina de outro. Isso ocorre durante a síntese de proteínas, quando os aminoácidos são unidos em uma cadeia polipeptídica. A reação resulta na liberação de uma molécula de água e na formação de um dipeptídeo, o primeiro passo na criação de polipeptídeos e proteínas.
379) Os aminoácidos são moléculas orgânicas que servem como unidade fundamental na formação de proteínas e desempenham importantes funções no organismo. Eles são classificados como aminoácidos essenciais, aqueles que os seres humanos não produzem, e aminoácidos não essenciais, aqueles que os seres humanos sintetizam. Com base nessas informações, assinale a alternativa que apresenta somente aminoácidos essenciais.
- A) fenilalanina, metionina, arginina e triptofano
- B) arginina, cisteína, glicina e tirosina
- C) fenilalanina, metionina, glutamina e treonina
- D) fenilalanina, metionina, treonina e arginina
- E) fenilalanina, metionina, treonina e triptofano
A alternativa correta é letra E) fenilalanina, metionina, treonina e triptofano. Esses são todos aminoácidos essenciais, o que significa que eles não podem ser sintetizados pelo corpo humano e devem ser obtidos através da dieta. A fenilalanina é um precursor da tirosina e de vários neurotransmissores e hormônios. A metionina é importante para a iniciação da tradução do RNA mensageiro e para a doação de grupos metil em muitas reações de metilação. A treonina é importante para a síntese de proteínas e enzimas e desempenha um papel na regulação do balanço de proteínas no corpo. O triptofano é um precursor do neurotransmissor serotonina e do hormônio melatonina, que estão envolvidos na regulação do humor e do sono.
380) A ricina, substância tóxica extraída da mamona, liga-se ao açúcar galactose presente na membrana
- A) RNA.
- B) DNA.
- C) lipídios.
- D) proteínas.
- E) carboidratos.
A alternativa correta é letra D) proteínas.
Gabarito da banca: Letra "D"
Entendimento: Letra "D"
Acompanhe minha análise:
A ricina entra na célula por ligação à membrana glicoproteica e glicolipídica que contém galactose. Visto que muitas moléculas de superfície celular contêm esse açúcar, a ricina se liga a muitas células. Depois de serem endocitadas e liberadas no citoplasma celular, a ricina mata a célula, bloqueando a síntese proteica. Mais especificamente, catalisa a modificação e a clivagem de uma das grandes moléculas de RNA que compreendem o ribossomo eucariótico – a bancada da síntese proteica. Uma única molécula de ricina no citoplasma pode modificar 1500 ribossomas, matando a célula em minutos.
As proteínas são a principal expressão fenotípica do genótipo – a informação genética codificada pelo DNA da célula. A ricina inibe a habilidade da célula em expressar o genótipo como fenótipo por meio da síntese de proteínas, e então as células envenenadas pela ricina não podem sobreviver. (SADAVA et al., 2020, p. 227, grifo meu).
Referência: SADAVA, D. et al. Vida: a ciência da biologia. 11. ed. Porto Alegre: Artmed, 2009. v. 1. Constituintes químicos da vida, células e genética.
