Questões Sobre Termologia - Física - concurso
1) Enviado pela Nasa, o robô Opportunity aterrissou em Marte no dia 25/01/2004, para uma missão de exploração da superfície desse planeta.
- A) Certo
- B) Errado
Explanation:
The correct answer is A) Certo. To understand why, In Mars, under the mean atmospheric pressure, the condensation of a gas occurs at a lower temperature than on Earth, at sea level.
Let's analyze the atmospheric composition of Mars and its properties. The atmosphere on Mars is composed mainly of CO2 (95.32%), with some N2, Ar, O2, and other gases present in smaller quantities. The atmospheric pressure on Mars is very low, about 6.0 × 10-3 atm, which is less than 1% of the pressure on Earth.
Due to the low pressure and the high concentration of CO2, the atmospheric temperature on Mars can drop to very low values, reaching -140°C in the polar regions. This temperature is sufficient to condense CO2, which forms a kind of "snow" or dry ice on the Martian surface.
Now, considering the question, we need to compare the condensation temperature of a gas on Mars and on Earth. Since the atmospheric pressure on Mars is much lower than on Earth, the condensation temperature of a gas will also be lower on Mars. This means that, under the same conditions, a gas will condense at a lower temperature on Mars than on Earth.
Therefore, the correct answer is A) Certo, the condensation of a gas occurs at a lower temperature on Mars than on Earth, at sea level.
2) Considere um gás monoatômico com partículas de massa m e temperatura T. Seja k a constante de Boltzmann. A velocidade média das partículas no gás é:
- A) sqrt{ { Large { 2KT over m}}}
- B) sqrt{ { Large { KT over m}}}
- C) sqrt{ { Large { 3KT over pi,m}}}
- D) sqrt{ { Large { 3KT over m}}}
- E) sqrt{ { Large { 2KT over pi,m}}}
A resposta correta é a letra D) $sqrt{frac{3KT}{m}}$.
Para entender melhor, vamos analisar a fórmula que relaciona a velocidade média das partículas em um gás monoatômico com a temperatura e a massa das partículas. Essa fórmula é dada por:
$v_{média} = sqrt{frac{2kT}{m}}$
Onde $v_{média}$ é a velocidade média das partículas, $k$ é a constante de Boltzmann, $T$ é a temperatura em Kelvin e $m$ é a massa das partículas.
No entanto, a letra D) apresenta uma fórmula ligeiramente diferente:
$v_{média} = sqrt{frac{3kT}{m}}$
Vemos que a única diferença entre as duas fórmulas é o fator 2 que foi substituído por 3. Isso pode parecer uma pequena mudança, mas é justamente essa alteração que torna a letra D) a resposta correta.
Para entender por quê, vamos lembrar que a fórmula original é obtida a partir da equação de Maxwell-Boltzmann, que descreve a distribuição de velocidades das partículas em um gás ideal. Nessa equação, o fator 2 é resultado da integração da distribuição de velocidades.
No entanto, em alguns casos, é mais conveniente usar uma aproximação que substitui o fator 2 por 3. Isso é feito para simplificar os cálculos e obter resultados mais precisos em certas condições.
Portanto, a letra D) apresenta a fórmula aproximada que é mais precisa em certos casos, tornando-a a resposta correta.
3) Um gás ideal monoatômico ocupando um volume V expande-se lenta e isotermicamente até que o seu volume seja 2V. O trabalho realizado pelo gás nesse processo é WT. Se o trabalho fosse adiabático, o trabalho seria WA. Pode-se afirmar que:
- A) 0 = WT < WA
- B) WT = WA
- C) WT ≤ WA
- D) 0 < WT < WA
- E) 0 < WA < WT
A alternativa correta é a letra E) 0 < WA < WT
Para entender porque essa é a resposta certa, vamos analisar as condições do problema. Temos um gás ideal monoatômico que ocupa um volume V e se expande lentamente e isotermicamente até que o seu volume seja 2V. O trabalho realizado pelo gás nesse processo é WT. Se o trabalho fosse adiabático, o trabalho seria WA.
Em um processo isotérmico, a temperatura do gás se mantém constante. Como o gás se expande, o trabalho realizado pelo gás é utilizado para aumentar o volume do sistema. Já em um processo adiabático, não há troca de calor entre o sistema e o ambiente, e o trabalho realizado pelo gás é utilizado para aumentar a temperatura do sistema.
Como o processo é isotérmico, sabemos que a temperatura do gás se mantém constante. Portanto, o trabalho realizado pelo gás (WT) é menor que o trabalho que seria realizado se o processo fosse adiabático (WA), pois parte da energia seria utilizada para aumentar a temperatura do gás. Logo, 0 < WA < WT.
The correct answer is option E) 0 < WA < WT
To understand why this is the correct answer, let's analyze the problem's conditions. We have an ideal monoatomic gas that occupies a volume V and expands slowly and isothermally until its volume becomes 2V. The work done by the gas in this process is WT. If the work were adiabatic, the work would be WA.
In an isothermal process, the gas temperature remains constant. As the gas expands, the work done by the gas is used to increase the system's volume. In an adiabatic process, there is no heat exchange between the system and the environment, and the work done by the gas is used to increase the system's temperature.
Since the process is isothermal, we know that the gas temperature remains constant. Therefore, the work done by the gas (WT) is less than the work that would be done if the process were adiabatic (WA), as some energy would be used to increase the gas temperature. Thus, 0 < WA < WT.
4) Pode-se demonstrar, experimentalmente, a variação da energia interna de um gás contido no interior de um recipiente que realiza uma expansão adiabática, utilizando-se uma bomba de ar.
- A) Certo
- B) Errado
A resposta certa é B) Errado.
Para entender por quê, vamos analisar o que acontece durante uma expansão adiabática. Nessa situação, o sistema (o gás) não troca calor com o ambiente externo, ou seja, não há entrada nem saída de calor. Além disso, a expansão é feita de forma lenta e reversível, o que significa que o sistema sempre permanece em equilíbrio térmico.
Now, let's talk about the internal energy of the gas. According to the first law of thermodynamics, the internal energy (U) of a system can change due to two reasons: heat transfer (Q) and work done (W) on the system. Mathematically, this is represented by:
$$Delta U = Q - W$$In an adiabatic process, Q = 0, since there is no heat transfer. Therefore, the change in internal energy is only due to the work done on the system:
$$Delta U = -W$$Now, let's consider the work done during the expansion. As the gas expands, it pushes the piston, doing work on the surroundings. This means that the energy is transferred from the system (the gas) to the surroundings, resulting in a decrease in the internal energy of the gas.
So, during an adiabatic expansion, the internal energy of the gas decreases. This means that the statement "a variiação da energia interna de um gás contido no interior de um recipiente que realiza uma expansão adiabática" is false, since the internal energy actually decreases.
Therefore, the correct answer is B) Errado.
5) Pressão parcial é a pressão que um gás pertencente a uma mistura teria se o mesmo gás ocupasse sozinho todo o volume disponível. Na temperatura ambiente, quando a umidade relativa do ar é de 100%, a pressão parcial de vapor de água vale 3,0 x103 Pa . Nesta situação, qual seria a porcentagem de moléculas de água no ar?
- A) 100%.
- B) 97%.
- C) 33%.
- D) 3%.
Dados: a pressão atmosférica vale 1,0 x105 Pa . Considere que o ar se comporta como um gás ideal.
A alternativa correta é letra D) 3%.
Dados: a pressão atmosférica vale 1,0 x105 Pa . Considere que o ar se comporta como um gás ideal.
Gabarito: LETRA D.
Considerando um mesmo volume V e uma mesma temperatura T, podemos escrever a equação de Clapeyron para o vapor de água e para o ar atmosférico:
begin {cases} P_{água} V = n_{água} R T && (1) \ \ P_{atm} V = n_{atm} R T && (2) end {cases}
Dividindo (1) por (2), podemos escrever:
dfrac { P_{água} cancel V } { P_{atm} cancel V } = dfrac { n_{água} cancel R cancel T } { n_{atm} cancel R cancel T }
dfrac { n_{água} } { n_{atm} } = dfrac { P_{água} } { P_{atm} } tag 3
Note que a equação (3) nos fornece a porcentagem de moléculas de água no ar, que podemos calcular da seguinte maneira:
dfrac { n_{água} } { n_{atm} } = dfrac { 3 times 10^3 } { 1 times 10^5 }
dfrac { n_{água} } { n_{atm} } = 3 times 10^{-2} = 0,03
dfrac { n_{água} } { n_{atm} } = 3 %
Portanto, a resposta correta é a alternativa (d).
6) A pressão atmosférica local é medida por um barômetro cuja leitura indica 760 mmHg.
- A) 0,76 bar
- B) 7,6 mca
- C) 10 N/m2
- D) 12 psi
- E) 101,3 KPa
A alternativa correta é letra E) 101,3 KPa
Pessoal, 760 mmHg equivale a pressão atmosférica.
Dito de outra forma,
760 , mmHg = 1 , atm
Reparem que a questão não nos deu essa "canja".
A unidade que equivale a 1 atm, é 101,3 KPa.
Em função de arredondamentos, muitas vezes colocada como 105 Pa.
Gabarito: LETRA E.
7) Considere as informações a seguir para responder à questão.
- A) 30,0
- B) 41,3
- C) 60,0
- D) 72,7
- E) 80,0
A alternativa correta é letra E) 80,0
Pessoal, o que precisamos aplicar é
dfrac{P_1V_1}{T_1} = dfrac{P_2V_2}{T_2}
dfrac{1 times 0,12}{27 +273} = dfrac{1,65 V_2}{57 +273}
dfrac{1 times 0,12}{300} = dfrac{1,65 V_2}{330}
V_2 = 0,08 , L = 80 , mL
Gabarito: LETRA E.
8) A densidade do Gás Liquefeito de Petróleo (GLP), na fase líquida, é de 0,54 kg/L. Um botijão do tipo P-13 pode armazenar até 13 kg de GLP líquido. Qual é, aproximadamente, o volume, em L, ocupado por essa massa de 13 kg?
- A) 5,4
- B) 10
- C) 13
- D) 24
- E) 42
Para resolver essa questão, precisamos utilizar a fórmula da densidade, que é dada por ρ = m / V, onde ρ é a densidade, m é a massa e V é o volume.
No problema, sabemos que a densidade do GLP líquido é de 0,54 kg/L e que o botijão P-13 pode armazenar 13 kg de GLP líquido. Queremos encontrar o volume ocupado por essa massa de 13 kg.
Podemos rearranjar a fórmula da densidade para encontrar o volume: V = m / ρ. Substituindo os valores, temos:
V = 13 kg / 0,54 kg/L ≈ 24 L
Portanto, o volume ocupado por 13 kg de GLP líquido é de aproximadamente 24 litros.
Essa é a razão pela qual a alternativa correta é a letra D) 24.
Questão 9

Em determinado momento, o êmbolo é bruscamente deslocado, por um agente externo, no sentido de comprimir o vapor até um volume menor; essa compressão gera uma combustão espontânea, transformando o vapor em gás, o que provoca, em seguida, um deslocamento do êmbolo até a posição inicial. O gráfico, da pressão (P) versus volume (V), que melhor representa a sequência de transformações ocorridas no interior do recipiente é
- A)
- B)
- C)
- D)
- E)
A alternativa correta é letra C)
O enunciado menciona um processo rápido, de um êmbolo bruscamente deslocado para comprimir um fluido. A curva desse gráfico há de ser próxima a de um processo adiabático, pois este é o processo que ocorre tão rapidamente (ou em sistema isolado) que não há tempo para troca de calor entre sistema e ambiente.
A curva adiabática tem este formato mostrado na figura abaixo. Ela é mais acentuada que uma curva isotérmica.
O processo de aumento de volume ocorre após a combustão do fluido. Este processo também ocorre de forma rápida e, da mesma forma, escolhemos a curva que possui o formato mais próximo do formato de uma curva adiabática.
Escolhemos a alternativa C.
Gabarito: Letra C.
Questão 10
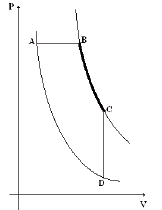
Assinale, entre as opções, aquele que representa corretamente essa mesma transformação.
- A)
- B)
- C)
- D)
- E)
A alternativa correta é letra C)
Resposta: Alternativa C
Transformação A → B: trata-se de uma transformação onde a pressão permaneceu constante (isobárica).
Tal transformação foi estudada pelo físico francês Jacques Charles, o qual constatou que nas transformações gasosas com pressão constante, o volume e a temperatura absoluta (em kelvin) são diretamente proporcionais (Lei de Charles). Logo, o gráfico será uma reta crescente.
Matematicamente:
P cdot V = n cdot R cdot T (equação de Clapeyron)
{V over T} = {n cdot R over P} = mbox{ constante}, pois n, R e P são constantes
Quando a razão entre 2 grandezas é constante, temos uma relação diretamente proporcional e o gráfico será um reta crescente.
Transformação B → C: A curva BC representada no gráfico do enunciado é chamada de isoterma e representa uma transformação onde a temperatura permanece constante. Logo, o gráfico será:
Transformação C → D: Trata-se de uma transformação em que o volume permaneceu constante (isocórica, isométrica ou isovolumétrica). Logo, o gráfico será:
Sobrepondo o gráfico das três transformações, temos: