Continua após a publicidade..
A distribuição de velocidades das moléculas de um gás em um recipiente (um balão, por exemplo) obedece à chamada distribuição de Maxwell de velocidades (DMV). O gráfico a seguir mostra a DMV na situação em que três recipientes idênticos contêm um mesmo número de moléculas de oxigênio para as temperaturas de -100 ºC, 20 ºC e 600 ºC. No gráfico, n(v) é o número de moléculas e v é a velocidade, em m/s. Nessa distribuição, a velocidade média das moléculas, a uma temperatura T, é sqrt {8kT/(m pi),} a velocidade mais provável de ser encontrada é sqrt {2kT/m} e a velocidade quadrática média é sqrt {3kT/m,} em que k é a constante de Bolztmann e m é a massa das partículas.
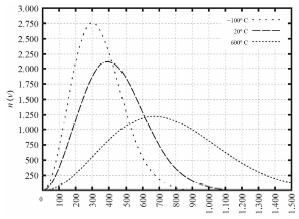
Tendo como referência as informações precedentes e considerando que o zero absoluto é -273,15 K e que a constante dos gases é R 0,082 L ⋅ atm ⋅ K-1 ⋅ mol-1, julgue o item a seguir.
Se os recipientes contêm 4 g de moléculas de oxigênio acondicionadas em 2 L, então, para T = -100 ºC, a pressão será inferior a 1 atm.
- A) Certo
- B) Errado
Resposta:
ESTA QUESTÃO FOI ANULADA, NÃO POSSUI ALTERNATIVA CORRETA
Pessoal, precisamos aplicar
P V = n R T
P V = dfrac{m}{MM} times R times T
P times 4 = dfrac{4}{32} times 0,082 times (273 - 100)
P = 0,39 , atm
Gabarito: ANULADA.
A questão, entretanto, foi ANULADA.

Deixe um comentário