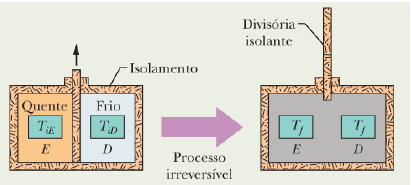
A figura abaixo mostra dois blocos de cobre iguais de massa m. Inicialmente, os blocos E e D estão, respectivamente, nas temperaturas T_{iE} e T_{iD} sendo T_{iE} > T_{iD}. Os blocos estão em uma caixa isolada termicamente e separados por uma divisória isolante. Quando removemos a divisória, os blocos atingem, depois de algum tempo, uma temperatura de equilíbrio T_f. Quanto à variação da entropia do bloco E, do bloco D e do sistema (bloco E + bloco D) durante este processo irreversível podemos, respectivamente, afirmar que:
- A) triangle S_E > 0, triangle S_D >, triangle S_{SIST} >0
- B) triangle S_E > 0, triangle S_D <, triangle S_{SIST} >0
- C) triangle S_E > 0, triangle S_D >, triangle S_{SIST} >0
- D) triangle S_E < 0, triangle S_D >, triangle S_{SIST} = 0
- E) triangle S_E > 0, triangle S_D <, triangle S_{SIST} = 0
Resposta:
Resposta: A alternativa correta é a letra C) ΔS_E > 0, ΔS_D > 0 e ΔS_SIST > 0.
Vamos analisar o processo que ocorre nessa situação. Inicialmente, os blocos E e D estão em temperaturas diferentes, T_E e T_D, respectivamente, com T_E > T_D. Quando removemos a divisória isolante, os blocos começam a se equilibrar térmicamente.
Como T_E > T_D, o bloco E está em uma temperatura mais alta do que o bloco D. Portanto, o bloco E perde calor e o bloco D ganha calor. Isso significa que a entropia do bloco E (ΔS_E) aumenta, pois o calor é transferido de uma região de alta temperatura para uma região de baixa temperatura, aumentando a desordem do sistema.
Já o bloco D, por sua vez, recebe calor e sua temperatura aumenta. Isso também aumenta a entropia do bloco D (ΔS_D), pois o calor é absorvido e a energia interna do sistema aumenta.
Quanto ao sistema como um todo (bloco E + bloco D), a entropia total também aumenta (ΔS_SIST > 0), pois a transferência de calor de um corpo para outro aumenta a desordem do sistema.
Portanto, a alternativa correta é a letra C) ΔS_E > 0, ΔS_D > 0 e ΔS_SIST > 0.

Deixe um comentário