A figura abaixo mostra dois frascos ligados por um tubo inicialmente fechado.
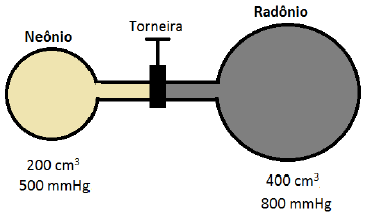
O frasco de 200 cm3 contém um gás Neônio à 500 mmHg, e o outro, de 400 cm3, contém Radônio à 800 mmHg. Supondo que a temperatura permaneça constante e os gases com comportamento ideal, a pressão final do sistema, quando a torneira é aberta e os gases se misturam completamente, vale
- A) 0,65 mmHg
- B) 0,7 mmHg
- C) 650 mmHg
- D) 700 mmHg
Resposta:
Resposta:
A alternativa correta é D) 700 mmHg.
Explicação:
Para resolver esse problema, devemos utilizar o princípio de Dalton, que afirma que a pressão total de um sistema é igual à soma das pressões parciais de cada gás.
No sistema em questão, temos dois frascos ligados por um tubo, cada um contendo um gás diferente. O frasco de 200 cm³ contém neônio a 500 mmHg, e o frasco de 400 cm³ contém radônio a 800 mmHg.
Quando a torneira é aberta e os gases se misturam, a pressão final do sistema é dada pela soma das pressões parciais de cada gás.
Primeiramente, devemos calcular a pressão parcial de cada gás em seu respectivo frasco. Para isso, utilizamos a fórmula:
Onde P é a pressão, n é o número de mols, R é a constante dos gases ideais, T é a temperatura em Kelvin e V é o volume do frasco.
Como a temperatura permanece constante, podemos considerá-la igual em ambos os frascos. Além disso, como os gases se comportam como ideais, podemos utilizar a fórmula acima.
Para o neônio:
Para o radônio:
Agora, podemos calcular a pressão total do sistema quando os gases se misturam:
Como o volume total do sistema é 600 cm³ (200 cm³ + 400 cm³), podemos calcular a pressão final do sistema:
Portanto, a alternativa correta é D) 700 mmHg.

Deixe um comentário