A figura representa, num diagrama p-V, dois processos através dos quais determinada massa de um gás ideal pode evoluir entre dois estados de equilíbrio termodinâmico A e B.
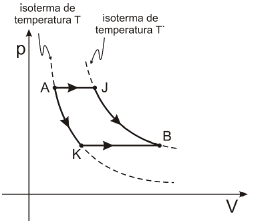
Quando o gás evolui através do processo AJB, recebe uma quantidade de calor Q1; já através do processo AKB, recebe uma quantidade de calor Q2.
Essas quantidades de calor são tais que
- A) Q1 < Q2.
- B) Q1 ≤ Q2.
- C) Q1 = Q2.
- D) Q1 ≥ Q2.
- E) Q1 > Q2.
Resposta:
A alternativa correta é letra E) Q1 > Q2.
Os gases realizam trabalho W de compressão ou expansão, conforme a seguinte expressão:
W = - PcdotDelta{V}
Então, notamos que o trabalho de um gás é função do produto da pressão pelo volume do gás.
O primeiro princípio da termodinâmica afirma que a quantidade de calor (Q) fornecida a um sistema é igual ao trabalho W realizado pelo gás mais a variação da energia interna (Delta U) sofrida por ele.
Q=W + Delta U
Q=- PcdotDelta{V} + Delta U
A energia interna de um gás depende exclusivamente de sua temperatura. Calculando a temperatura do gás nos dois estados através da equação de Clapeyron, teremos:
frac{pcdot V}{T}=ncdot R ,,, implies ,,, T=dfrac{pcdot V}{ncdot R}
Vejamos o que acontece nos processos:
1. AJB.
De A para J, ocorre uma transformação isobárica com aumento de volume (expansão) do sistema. Então, podemos afirmar que parte a energia Q_1 recebida pelo gás foi utilizada para realizar trabalho sobre o sistema e a outra parte na elevação da energia interna do gás e consequentemente sua temperatura.
De J para B, ocorre aumento de volume e diminuição de pressão e a temperatura permanece constante. Então, não há alteração da energia interna do gás de J para B. Portanto:
Q_1=- P_1cdotDelta{V_1} +W_{JB}+ Delta U tag 1
Onde W_{JB} é o trabalho de J para B, representado pela área abaixo da curva.
2. AKB.
De A para K, ocorre uma transformação térmica com aumento de volume e diminuição de pressão. Então, podemos afirmar que parte a energia Q_2 recebida pelo gás foi utilizada para realizar trabalho sobre o sistema.
De K para B, ocorre novamente uma transformação isobárica com aumento de volume (expansão) do sistema. Então, podemos afirmar que a outra parte a energia Q_2 recebida pelo gás foi utilizada para realizar trabalho sobre o sistema e a outra parte na elevação da energia interna do gás e consequentemente sua temperatura. Portanto:
Q_2=- P_2cdotDelta{V_2} +W_{AK}+ Delta Utag 2
Onde W_{AK} é o trabalho de A para K, representado pela área abaixo da curva.
Obs: Nota-se que as áreas W_{AK} e W_{JB} são muito parecidas. Então, podemos considerá-las iguais. Comparando as equações (1) e (2), percebemos que a maior diferença entre as energias Q_1 e Q_2 se dá no produto PcdotDelta{V}. Logo, como a pressão P_1 > P_2, então Q_1 > Q_2.
Gabarito: E

Deixe um comentário