Analise o gráfico abaixo.
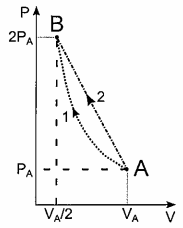
Um mol de certo gás ideal monoatômico, no estado inicial (P_A, V_A, T_B ) deve ter sua pressão dobrada e seu volume reduzido á metade, atingindo o estado (P_B , V_B , T_B ). Para isso, dois processos distintos são testados separadamente: o processo 1 é isotérmico, com o gás cedendo ao meio externo um calor Q_1. Já no processo 2, a curva AB é retilínea, e o calor cedido pelo gás é Q_2 = Q_1/0,92. Sendo R a constante dos gases ideais, o produto RT_A=U_0 e W_1 o trabalho realizado sobre o gás no processo 1, a razão W_1/U_0 vale:
- A) 0,90
- B) 0,75
- C) 0,69
- D) 0,50
- E) 0,32
Resposta:
A alternativa correta é letra C) 0,69
Gabarito: C
Analise o gráfico abaixo.

Um mol de certo gás ideal monoatômico, no estado inicial (P_A, V_A, T_B) deve ter sua pressão dobrada e seu volume reduzido á metade, atingindo o estado (P_B, V_B, T_B). Para isso, dois processos distintos são testados separadamente: o processo 1 é isotérmico, com o gás cedendo ao meio externo um calor Q_1. Já no processo 2, a curva AB é retilínea, e o calor cedido pelo gás é Q_2 = Q_1/0,92. Sendo R a constante dos gases ideais, o produto RT_A=U_0 e W_1 o trabalho realizado sobre o gás no processo 1, a razão W_1/U_0 vale:
Resolução:
Primeiramente, vamos analisar o processo 2. Como a temperatura final é igual a inicial, não há variação de energia interna. Assim, de acordo com a primeira lei da termodinâmica, temos:
Delta U_2 = Q_2 - W_2 = 0
Logo,
Q_2 = W_2
Entretanto, sabemos que o valor de W_2 é numericamente igual à área sob a curva do processo 2, que se trata de um trapézio de base maior 2P_A e base menor P_A e altura V_A/2, como nos mostra a figura a seguir:
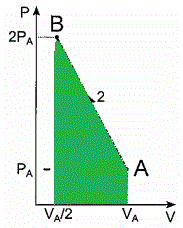
Assim, temos que:
Q_2 = W_2 = dfrac { left( 2 P_A + P_A right) cdot dfrac { V_A } 2 } 2
Q_2 = dfrac { 3 P_A V_A } 4
Entretanto, do enunciado, temos que Q_2 = Q_1/0,92. Então, temos que
dfrac { Q_1 } { 0,92 } = dfrac { 3 P_A V_A } 4
Q_1 = dfrac { 3 cdot 0,92 P_A V_A } 4
Q_1 = dfrac { 2,76 P_A V_A } 4
Q_1 = 0,69 P_A V_A
Por outro lado, de acordo com a lei geral dos gases ideais, temos que P_A V_A = nRT_A. Substituindo-se na equação acima, temos que
Q_1 = 0,69 nRT_A
De acordo com o enunciado, temos que n=1 e RT_A = U_0. Assim, a equação acima se torna
Q_1 = 0,69 cdot 1 cdot U_0
Q_1 = 0,69 U_0 tag 1
Como as temperaturas inicial e final também são iguais para o processo 1, temos que Delta U_1 = 0. Com isso, temos que
Q_1 - W_1 = 0
Logo,
Q_1 = W_1
Assim, substituindo-se Q_1 na equação (1), temos
W_1 = 0,69 U_0
dfrac { W_1 } { U_0 } = 0,69
Portanto, a resposta correta é a alternativa (C).

Deixe um comentário