Considere que um gás ideal é submetido aos processos nos quais a pressão final é pf, volume final é vf, pressão inicial pi e o volume inicial é dado por vi. O processo 1 mostrado na figura abaixo é isotérmico, no processo 2 a pressão é constante e, então, o volume permanece constante. Qual das expressões abaixo representa a razão entre o trabalho W1 realizado sobre o gás no primeiro processo e W2 realizado no segundo processo?
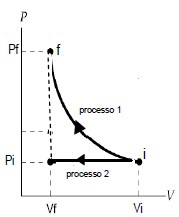
- A) dfrac{W_1}{W_2} =dfrac{(P_f-P_i)}{2_P}
- B) dfrac{W_1}{W_2} =dfrac{V_i,lnBigl(dfrac{V_f}{V_i}Bigl)}{V_f-V_i}
- C) dfrac{W_1}{W_2} =dfrac{V_i,lnBigl(dfrac{V_f}{V_i}Bigl)}{V_f,ln(V_f-V_i)}
- D) dfrac{W_1}{W_2} =dfrac{2_{Pf}V_i,lnBigl(dfrac{V_f}{V_i}Bigl)}{P_i(V_f-V_i)}
- E) dfrac{W_1}{W_2} =dfrac{P_f(V_f-V_i)}{2_{Pi}(V_i-V_f)}
Resposta:
A razão entre o trabalho W1 realizado sobre o gás ideal no primeiro processo e W2 realizado no segundo processo é dada pela expressão:
$$dfrac{W_1}{W_2} = dfrac{V_i ln left( dfrac{V_f}{V_i} right)}{V_f - V_i}$$
Essa é a alternativa correta B) porque, trabalho realizado sobre um gás ideal em um processo isotérmico é relacionado ao volume inicial V_i e ao volume final V_f, além da constante de Boltzmann. No processo 1, o gás se expande isotermicamente, o que significa que a temperatura permanece constante. Nesse caso, o trabalho realizado é igual ao produto da pressão pela variação do volume. No processo 2, a pressão é constante, o que significa que o trabalho realizado é igual à área abaixo da curva de pressão em função do volume.
A expressão acima é obtida a partir da integração do trabalho elemento dW com relação ao volume dV, considerando que a temperatura é constante no processo 1:
$$W_1 = int_{V_i}^{V_f} P dV = nRT int_{V_i}^{V_f} dfrac{dV}{V} = nRT ln left( dfrac{V_f}{V_i} right)$$
Já no processo 2, o trabalho realizado é igual à área abaixo da reta de pressão constante:
$$W_2 = P(V_f - V_i)$$
Portanto, a razão entre os trabalhos W1 e W2 é dada pela expressão:
$$dfrac{W_1}{W_2} = dfrac{V_i ln left( dfrac{V_f}{V_i} right)}{V_f - V_i}$$

Deixe um comentário