Durante um processo físico, a informação mais importante é a relativa à variação da entropia, e não a do seu valor absoluto. No século XIX, Clausius determinou que a variação da entropia de um sistema, em um processo reversível e à temperatura T, em Kelvin, é dada por DeltaS = DeltaQ/T, em que DeltaQ é a quantidade de calor adicionado. Com relação a esse conceito, considere a situação em que 30 g de gelo, inicialmente a 0 ºC, transforma-se em água a 0 ºC. Considere, ainda, que o calor latente de fusão do gelo seja 80 cal/g.
Com base nessas informações, julgue o próximo item.
A figura a seguir ilustra uma possível representação do diagrama de fase da água, na qual consta o ponto triplo, região em que ocorrem, simultaneamente, os estados gasoso, líquido e sólido.
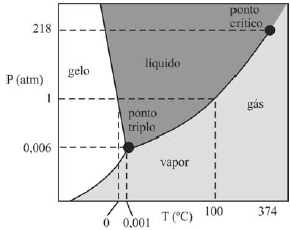
- A) Certo
- B) Errado
Resposta:
A resposta certa é a letra A) Certo.
Essa afirmação está relacionada à variação da entropia em um sistema durante um processo físico. A entropia é uma grandeza termodinâmica que mede o grau de desordem ou aleatoriedade de um sistema. Durante um processo reversível, a variação da entropia (ΔS) está relacionada à quantidade de calor adicionado ao sistema (ΔQ) e à temperatura (T) em que ocorre o processo, segundo a fórmula:
$$Delta S = frac{Delta Q}{T}$$
No caso do problema, temos 30 g de gelo que se transformam em água a 0°C. Para isso, é necessário fornecer ao sistema uma quantidade de calor igual ao calor latente de fusão do gelo, que é de 80 cal/g. Logo, a quantidade total de calor fornecida é de:
$$Delta Q = 30 times 80 = 2400 text{ cal}$$
Como a temperatura é constante e igual a 0°C (ou 273 K), podemos calcular a variação da entropia:
$$Delta S = frac{Delta Q}{T} = frac{2400}{273} approx 8,79 frac{text{cal}}{text{K}}$$
Portanto, a afirmativa está correta, pois a informação mais importante sobre o processo é a variação da entropia, e não o seu valor absoluto.

Deixe um comentário