Em um recipiente de paredes rígidas, estão confinados 4 mols de um gás monoatômico ideal que, ao absorver determinada quantidade de calor, sofreu uma transformação isovolumétrica entre dois estados, I e II, representada no diagrama P x V.
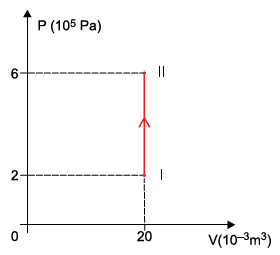
Adotando os valores R = 8 { large J over mol ⋅ K} para a constante universal dos gases e C_V = 12 { large J over mol ⋅ K} para o calor específico molar desse gás a volume constante, a quantidade de calor absorvida pelo gás para que sofresse tal transformação foi de
- A) 16 000 J.
- B) 14 000 J.
- C) 18 000 J.
- D) 12 000 J.
- E) 10 000 J.
Resposta:
A alternativa correta é letra D) 12 000 J.
Aplicando a equação dos gases perfeitos para o estado I, podemos encontrar a temperatura do gás neste estado.
P_I V_I = n R T_I
T_I = dfrac{P_I V_I}{n R}
T_I = dfrac{(2 times 10^5) cdot (20times 10^{-3})}{4 cdot 8}
T_I = dfrac{40 times 10^2}{32}
bbox[8px, border: 1px solid black]{color{black}{T_I = 125 ,K}}
Calculando a temperatura do gás no estado II, temos:
P_{II} V_{II} = n R T_{II}
T_{II} = dfrac{P_{II} V_{II}}{n R}
T_{II} = dfrac{(6 times 10^5) cdot (20times 10^{-3})}{4 cdot 8}
T_{II} = dfrac{120 times 10^2}{32}
bbox[8px, border: 1px solid black]{color{black}{T_{II} = 375 ,K}}
O calor específico molar a volume constante é a razão entre a quantidade de energia fornecida (Q), a variação de temperatura (Delta theta) sofrida pelo gás e o número de mols (n) para uma transformação a volume constante. Podemos verificar isso também analisando a unidade de (C_V) dado no enunciado.
begin{aligned} { [C_V] = dfrac{mbox{joule}}{mbox{mol} cdot mbox{Kelvin}}=dfrac{overbrace{mbox{joule}}^{Q}}{underbrace{mbox{mol}}_{n}cdot underbrace{mbox{Kelvin}}_{Delta theta}} \ , \ , \ [C_V] = dfrac{[Q]}{[n] cdot [Delta theta]} \ , \ , \ C_V = dfrac{Q}{n cdot Delta theta} \ , \ , \ bbox[8px, border: 1px solid black]{color{black}{Q = C_V cdot n cdot Delta theta}} } end{aligned}
Calculando a variação de temperatura:
begin{aligned} { Delta theta = T_{II}-T_{I} \ , \ , \ Delta theta = 375 - 125 \ , \ , \ bbox[8px, border: 1px solid black]{color{black}{Delta theta = 250,K }}} end{aligned}
Substituindo na expressão acima:
begin{aligned} { Q = C_V cdot n cdot Delta theta \ , \ , \ Q = 12 cdot 4 cdot 250 \ , \ , \ bbox[8px, border: 2px solid black]{color{#3498db}{Q = 12,000,J }}} end{aligned}
Portanto, a quantidade de calor absorvida pelo gás para que sofresse a transformação isovolumétrica entre os estados I e II foi de color{#3498db}{12 ,000 mbox{ J}}.

Deixe um comentário