Na figura a seguir, um mol de um gás ideal evolui do estado N para o estado M, obedecendo à lei de Boyle. Sendo P1 = 2,0×105 Pa, P2 = 8,0×105 Pa, V1 = 1,245×10-3 m³ e R = 8,3 J/mol.K,
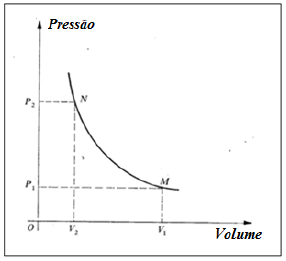
- A) o processo é adiabático.
- B) o trabalho é realizado sobre o gás.
- C) no processo a pressão se mantém constante.
- D) a temperatura do estado M é 300°C.
- E) a temperatura do processo é -243°C.
Resposta:
A alternativa correta é letra E) a temperatura do processo é -243°C.
A lei de Boyle estabelece que, em uma transformação isotérmica, a pressão e o volume de um gás ideal confinado são inversamente proporcionais, ou seja:
P_1 cdot V_1 = P_2 cdot V_2
Assim, vamos analisar cada uma das alternativas:
a) o processo é adiabático. INCORRETA.
Em um processo adiabático, não há troca de calor. Como gás ideal evolui do estado N para o estado M através de uma transformação isotérmica, pela primeira lei da termodinâmica (Delta U = Q - W), podemos afirmar que, se a temperatura não varia, a variação do volume do gás se deve ao calor absorvido. Logo, o processo não é adiabático. Alternativa incorreta.
b) o trabalho é realizado sobre o gás. INCORRETA.
Como o volume do estado M é maior do que o volume do estado N, o trabalho é realizado pelo gás, e não sobre ele. Alternativa incorreta.
c) no processo a pressão se mantém constante. INCORRETA.
Como podemos ver no gráfico, a pressão não é mantida constante. Alternativa incorreta.
d) a temperatura do estado M é 300°C. INCORRETA.
De acordo com a lei dos gases ideais, temos que:
PV = nRT
Logo,
T = dfrac { PV } { nR}
Então, para P_1 = 2,0 times 10^5 , Pa e V_1 = 1,245 times 10^{-3} , m^3, temos que:
T = dfrac { 2,0 times 10^5 cdot 1,245 times 10^{-3} } { 1 cdot 8,3 }
T = 30 , K = - 243 , °C
Alternativa incorreta.
e) a temperatura do processo é -243°C. CORRETA.
Alternativa correta. Vide comentário anterior.
Portanto, a resposta correta é a alternativa (E).

Deixe um comentário