O calorímetro ideal é um dispositivo adiabático em que a troca de calor ocorre apenas em seu interior, entre os elementos nele inseridos. Em uma prática de laboratório, um laboratorista deseja determinar o calor específico de um pequeno bloco metálico de massa conhecida igual a 100 g. Dessa forma, ele o coloca no interior do calorímetro, a uma temperatura de 160 oC, que já continha 44 g, calor específico 1 cal/goC, a 0 ºC de temperatura, e aguarda o equilíbrio térmico ser estabelecido. Considere o calor específico de alguns metais presentes na tabela a seguir.
Calor específico dos metais
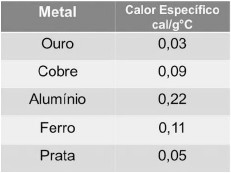
Conhecendo a temperatura de equilíbrio de 32 ºC, o laboratorista, então, inicia os cálculos para determinar o valor do calor específico do metal.
Consultando os dados fornecidos pela tabela, qual foi o metal encontrado por ele?
- A) Ouro.
- B) Cobre.
- C) Alumínio.
- D) Ferro.
- E) Prata.
Resposta:
ESTA QUESTÃO FOI ANULADA, NÃO POSSUI ALTERNATIVA CORRETA
A quantidade de calor recebida ou cedida por uma substância é dada pela seguinte expressão:
Q=mcDelta{T}
Quando dois materiais diferentes trocam calor, a quantidade de calor cedida por um será igual ao calor recebido pelo outro. No caso em questão, o material de maior temperatura é que cederá calor para o de menor temperatura até ocorrer o equilíbrio térmico em 32 ºC.
Q_{cedida}=Q_{recebida}
vert 100times c_{metal}times(32-160)vert=vert 44times 1times(32-0)vert
100times c_{metal}times128=44times32
c_{metal}=frac{11}{100}=0,11
A questão foi anulada. Acreditamos que talvez isso possa ter acontecido porque a banca não mencionou qual era a substância no interior do calorímetro, o que poderia confundir o candidato.
Gabarito do professor: D
Gabarito da banca: ANULADA

Deixe um comentário