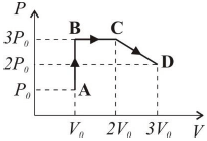
O diagrama P x V ao lado ilustra uma sequência de processos termodinâmicos executada por um gás ideal monoatômico, passando pelos pontos A, B, C e D, caracterizados pelos valores de pressão e volume apresentados no diagrama. Tendo em vista as informações apresentadas no diagrama, considere as seguintes afirmativas:
Assinale a alternativa correta.
- A) Somente as afirmativas 1 e 2 são verdadeiras.
- B) Somente as afirmativas 2 e 3 são verdadeiras.
- C) Somente as afirmativas 3 e 4 são verdadeiras.
- D) Somente as afirmativas 1, 2 e 4 são verdadeiras.
- E) As afirmativas 1, 2, 3 e 4 são verdadeiras.
Resposta:
A alternativa correta é letra A) Somente as afirmativas 1 e 2 são verdadeiras.
Vamos analisar cada uma das afirmativas:
O processo A→B é isométrico. CORRETA. O volume nos pontos A e B são iguais, logo o processo é chamado de isométrico.
Os pontos C e D estão à mesma temperatura. CORRETA. Podemos encontrar a relação de temperatura entre os pontos C e D através da equação geral dos gases:
dfrac {P_C V_C}{T_C} = dfrac {P_D V_D}{T_D}
Do gráfico, temos:
dfrac {3 P_0 cdot 2 V_0}{T_C} = dfrac {2 P_0 cdot 3 V_0}{T_D}
T_C = T_D
Logo, os pontos C e D estão à mesma temperatura.
O trabalho realizado pelo gás no processo B→C é nulo. INCORRETA. No processo B→C, temos uma variação de volume a pressão constante. O trabalho pode ser calculado da seguinte forma:
tau = P cdot Delta V
tau = 3 P_0 cdot (2V_0 - V_0)
tau = 3 P_0 cdot V_0
Portanto, o trabalho não é nulo.
O processo C→D é isobárico. INCORRETA. O processo C→D varia de 3 P_0 para 2 P_0. Portanto, não é isobárico.
Apenas as afirmativas 1 e 2 são verdadeiras, portanto o gabarito da questão é a alternativa (a).

Deixe um comentário