O diagrama Volume versus Temperatura, a seguir, representa uma transformação gasosa, I → II → III, sofrida por um mol de gás ideal.
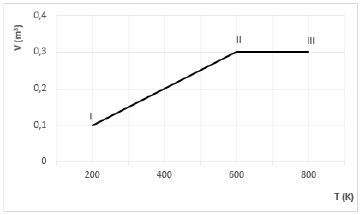
Considerando R = 2,0 cal/mol.K, qual é o trabalho realizado pelo gás nesse processo?
- A) 800 J
- B) 4 000 J
- C) 800 cal
- D) 4 000 cal
Resposta:
A alternativa correta é letra C) 800 cal
Sabemos que o trabalho realizado por um gás é dado por:
W = displaystyle int P dV
Como o volume é constante na transformação II rightarrow III, o trabalho é realizado pelo gás apenas na transformação I rightarrow II. De acordo com a lei geral dos gases, temos:
dfrac { P_{I} V_{I} }{ T_{I} } = dfrac { P_{II} V_{II} }{ T_{II} }
dfrac { P_{I} cdot 0,1 }{ 200 } = dfrac { P_{II} cdot 0,3}{ 600 }
P_{I} = P_{II}
Como a pressão é mantida constante, podemos encontrar o trabalho através da equação:
W = P Delta V
Sabendo a temperatura e o volume, podemos encontrar a pressão do gás utilizando a equação de estado dos gases perfeitos:
PV = nRT
Do gráfico, temos:
P_I V_I = nRT_I
P_I = dfrac {nRT_I}{V_I}
Assim, temos:
W = P Delta V
W = P_I cdot (V_{II} - V_{I})
W =dfrac {nRT_I}{V_I} cdot (V_{II} - V_{I})
W =dfrac {1,0 cdot 2,0 cdot 200}{0,1} cdot (0,3 - 0,1)
W = 800 cal
Note que usamos a constante R = 2,0 cal/mol.K, na qual a energia é dada em calorias.
Portanto, a resposta correta é a alternativa (C).

Deixe um comentário