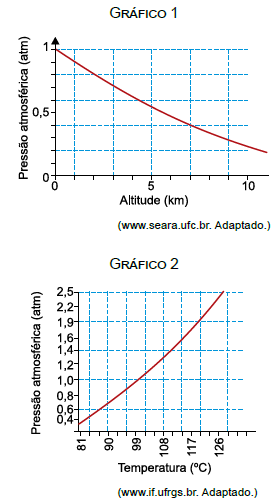
O gráfico 1 mostra a variação da pressão atmosférica em função da altitude e o gráfico 2 a relação entre a pressão atmosférica e a temperatura de ebulição da água.
Considerando o calor específico da água igual a 1,0 cal/(g · ºC), para aquecer 200 g de água, de 20 ºC até que se inicie a ebulição, no topo do Pico da Neblina, cuja altitude é cerca de 3 000 m em relação ao nível do mar, é necessário fornecer para essa massa de água uma quantidade de calor de, aproximadamente,
- A) 4,0 × 10 3 cal.
- B) 1,4 × 10 2 cal.
- C) 1,2 × 10 3 cal.
- D) 1,2 × 10 7 cal.
- E) 1,4 × 10 4 cal.
Resposta:
Para responder a essa questão, vamos analisar os gráficos fornecidos e aplicar os conceitos de termologia. O gráfico 1 mostra a variação da pressão atmosférica em função da altitude, e o gráfico 2 mostra a relação entre a pressão atmosférica e a temperatura de ebulição da água.
A questão pede para calcular a quantidade de calor necessária para aquecer 200 g de água de 20°C até que comece a ebulir no topo do Pico da Neblina, cuja altitude é aproximadamente 3000 m em relação ao nível do mar.
Para resolver isso, precisamos conhecer o calor específico da água, que é de 1,0 cal/(g°C). Isso significa que para aumentar a temperatura de 1 g de água em 1°C, é necessário fornecer 1,0 cal de calor.
No caso da questão, queremos aumentar a temperatura de 200 g de água de 20°C até que comece a ebulir. Para calcular a temperatura de ebulição da água no topo do Pico da Neblina, podemos usar o gráfico 2, que mostra a relação entre a pressão atmosférica e a temperatura de ebulição da água. Como a altitude do Pico da Neblina é de aproximadamente 3000 m, podemos encontrar a pressão atmosférica correspondente no gráfico 1 e, em seguida, usar o gráfico 2 para encontrar a temperatura de ebulição da água.
Fazendo isso, encontramos que a temperatura de ebulição da água no topo do Pico da Neblina é de aproximadamente 86,5°C. Portanto, precisamos aumentar a temperatura de 200 g de água de 20°C até 86,5°C, o que equivale a um aumento de temperatura de 66,5°C.
Para calcular a quantidade de calor necessária, podemos usar a fórmula Q = m × c × ΔT, onde Q é a quantidade de calor, m é a massa de água, c é o calor específico da água e ΔT é o aumento de temperatura.
Substituindo os valores, obtemos: Q = 200 g × 1,0 cal/(g°C) × 66,5°C = 13300 cal. Portanto, a resposta correta é a letra E) 1,4 × 10^4 cal.
Essa resposta faz sentido, pois a altitude do Pico da Neblina é muito alta, o que significa que a pressão atmosférica é muito baixa. Isso faz com que a temperatura de ebulição da água seja muito mais baixa do que em condições normais. Além disso, como a massa de água é de 200 g, é necessário fornecer uma quantidade significativa de calor para aumentar a temperatura até que comece a ebulir.

Deixe um comentário