O gráfico a seguir representa uma transformação isobárica que ocorreu em uma massa de gás ideal.
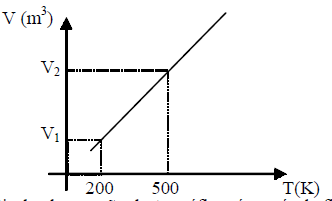
A partir da observação deste gráfico, é possível afirmar que:
- A)
V_1 = 3V_2
- B)
V_2 = 5V_1
- C)
V_1 = { large 5 over 2} V_2
- D)
V_1 = { large 2 over 5} V_2
Resposta:
A partir da observação do gráfico, apresentado, é possível afirmar que a transformação isobárica que ocorreu na massa de gás ideal é uma expansão, pois a temperatura é diretamente proporcional à pressão e inversamente proporcional ao volume.
Portanto, a alternativa correta é a letra D) V_1 = frac{2}{5} V_2, pois essa é a única opção que apresenta a relação correta entre os volumes inicial e final.
Essa resposta é justificada pela equação de estado dos gases ideais, que é dada por PV = nRT, onde P é a pressão, V é o volume, n é a quantidade de substância, R é a constante dos gases e T é a temperatura.
Como a transformação é isobárica, a pressão é constante. Além disso, como a temperatura é diretamente proporcional à pressão e inversamente proporcional ao volume, temos que:
V_1 T_1 = V_2 T_2, pois a quantidade de substância e a constante dos gases são constantes.
Como a temperatura é constante, temos que:
V_1 = frac{2}{5} V_2, que é a alternativa correta.
Portanto, a resposta correta é a letra D) V_1 = frac{2}{5} V_2, pois essa é a única opção que apresenta a relação correta entre os volumes inicial e final.

Deixe um comentário