O gráfico abaixo representa o diagrama de fases de uma determinada substância.
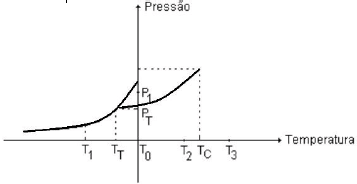
Da análise do gráfico, conclui-se que
- A) aumentando a pressão e mantendo a temperatura constante em T_1, ocorrerá vaporização da substância
- B) à temperatura T_3 é possível liquefazer a substância.
- C) sob pressão P_T e temperatura T_0 a substância apresentará pelo menos a fase líquida
- D) com a pressão mantida constante em P_1 e variando a temperatura de T_1 a T_2, a substância sofrerá duas mudanças de estado.
Resposta:
Resposta
A alternativa correta é a letra D) com a pressão mantida constante em $P_1$ e variando a temperatura de $T_1$ a $T_2$, a substância sofrerá duas mudanças de estado.
Explicação
Para entender a resposta, essa questão é relacionada ao diagrama de fases de uma substância, que apresenta as mudanças de estado em função da temperatura e pressão. No diagrama, observamos que há uma curva que separa as fases líquida e gasosa, que é chamada de curva de vaporização.
Analise a curva de vaporização: quando a temperatura é constante em $T_1$, aumentando a pressão, a substância passa da fase gasosa para a fase líquida. Isso ocorre porque a pressão aumenta a força intermolecular entre as moléculas, fazendo com que elas se aproximem e sejam mais atraídas entre si, resultando em uma mudança de estado.
Agora, se mantivermos a pressão constante em $P_1$ e variarmos a temperatura de $T_1$ a $T_2$, a substância passará por duas mudanças de estado: primeiro, da fase líquida para a fase gasosa, e posteriormente, da fase gasosa para a fase líquida novamente.
Portanto, a alternativa correta é a letra D) com a pressão mantida constante em $P_1$ e variando a temperatura de $T_1$ a $T_2$, a substância sofrerá duas mudanças de estado.

Deixe um comentário