O gráfico mostra as curvas de quantidade de calor absorvido em função da temperatura para dois corpos distintos: um bloco de metal e certa quantidade de líquido.
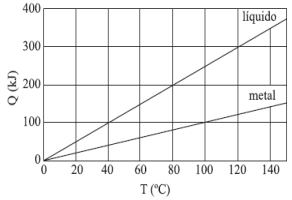
O bloco de metal, a 115 ºC, foi colocado em contato com o líquido, a 10 ºC, em um recipiente ideal e isolado termicamente. Considerando que ocorreu troca de calor somente entre o bloco e o líquido, e que este não se evaporou, o equilíbrio térmico ocorrerá a
- A) 40 ºC.
- B) 55 ºC.
- C) 50 ºC.
- D) 60 ºC.
- E) 70 ºC.
Resposta:
A resposta certa é a letra B) 55°C.
Para entender essa resposta, é preciso analisar o gráfico fornecido. Nele, podemos ver que a quantidade de calor absorvido pelo metal e pelo líquido varia em função da temperatura. No entanto, é importante notar que o equilíbrio térmico é alcançado quando a temperatura do metal e do líquido se igualam.
No gráfico, vemos que a curva do metal cruza a curva do líquido em torno de 55°C. Isso significa que, nessa temperatura, a quantidade de calor absorvido pelo metal é igual à quantidade de calor absorvido pelo líquido. Portanto, é nessa temperatura que o equilíbrio térmico é alcançado.
Além disso, é importante lembrar que, como o metal e o líquido estão em contato em um recipiente ideal e isolado termicamente, não há perda de calor para o meio ambiente. Dessa forma, a única forma de troca de calor é entre o metal e o líquido. Como o líquido não se evaporou, a temperatura final alcançada é a temperatura de equilíbrio.
Portanto, a resposta certa é a letra B) 55°C, pois é a temperatura em que o equilíbrio térmico é alcançado entre o metal e o líquido.

Deixe um comentário