Questões Sobre Termologia - Física - concurso
Questão 91
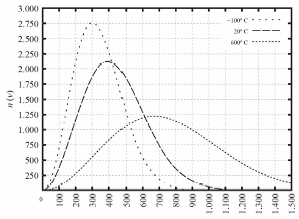
Tendo como referência as informações precedentes e considerando que o zero absoluto é -273,15 K e que a constante dos gases é R 0,082 L ⋅ atm ⋅ K-1 ⋅ mol-1, julgue o item a seguir.
A DMV implica na possibilidade de violação de um ou mais princípios da Teoria da Relatividade Especial.
- A) Certo
- B) Errado
A alternativa correta é letra A) Certo
Pessoal, realmente.
A DMV é aplicada a velocidade de gases que, normalmente, não excedem a velocidade da luz.
A Teoria da Relatividade Espacial se aplica a velocidades inferiores a da luz.
Entretanto, a DMV pode ser aplicada a gases extremamente aquecidos, situação essa que violaria os princípios da TRE.
Logo, pelo termo "possibilidade" no enunciado, a questão está correta.
Gabarito: CERTO.
Questão 92
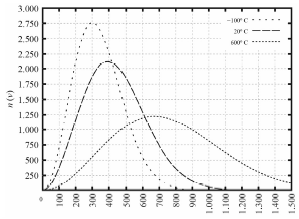
Tendo como referência as informações precedentes e considerando que o zero absoluto é -273,15 K e que a constante dos gases é R 0,082 L atm K-1 mol-1, julgue o item a seguir.
Um corpo de massa 1 kg com energia cinética constante igual a 3 J irá produzir uma temperatura superior a 6 ºC.
- A) Certo
- B) Errado
ESTA QUESTÃO FOI ANULADA, NÃO POSSUI ALTERNATIVA CORRETA
Pessoal, vamos calcular a velocidade de tal corpo.
É estranho usar a fórmula de energia cinética para calcular gases. Porém, como o corpo tem 1 kg, podemos utiliza-la
E_C = dfrac{mv^2}{2}
3 = dfrac{1.000 v^2}[2}
v = sqrt {dfrac{6}{1.000}}
Reparem que esse valor é minúsculo, o que para uma questão como essa não se aplica.
Gabarito: ANULADA.
Questão 93
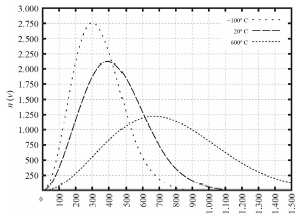
Tendo como referência as informações precedentes e considerando que o zero absoluto é -273,15 K e que a constante dos gases é R 0,082 L ⋅ atm ⋅ K-1 ⋅ mol-1, julgue o item a seguir.
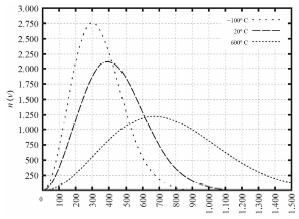
Para T , = , -100 , ºC, a velocidade quadrática média das moléculas será igual a 300 sqrt {3} , m/s.
- A) Certo
- B) Errado
ESTA QUESTÃO FOI ANULADA, NÃO POSSUI ALTERNATIVA CORRETA
Pessoal, segundo o enunciado, temos que
v_{QM} = sqrt {dfrac{3 k T}{m}}
v_{QM} = sqrt {dfrac{3 k T}{n times MM}}
Na velocidade dada, temos que a velocidade seria 520 m/s aproximadamente, isso forneceria um número n de aproximadamente 1.250
v_{QM} = sqrt {dfrac{3 times 1,38 times 10^{-23} times 127,15}{1.250 times 32}}
Reparem que a constante de Boltzmann coloca o valor em uma escala muito pequena, que não condiz com a velocidade de um gás.
Gabarito: ANULADA.
Questão 94
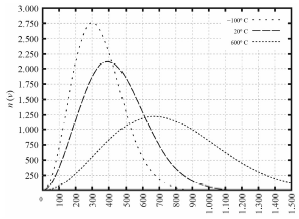
Tendo como referência as informações precedentes e considerando que o zero absoluto é -273,15 K e que a constante dos gases é R 0,082 L ⋅ atm ⋅ K-1 ⋅ mol-1, julgue o item a seguir.
As três curvas apresentadas no gráfico têm a mesma área.
- A) Certo
- B) Errado
A alternativa correta é letra A) Certo
Pessoal, o que temos nessa questão é um gráfico de distribuição de probabilidades.
A área sob a curva da distribuição de Maxwell-Boltzmann representa a probabilidade total e é sempre igual a 1 (ou 100% se considerada em termos percentuais). Isso significa que, independentemente da temperatura, a integral (soma da área) da função de distribuição sobre todas as velocidades é a mesma.
Logo,
Gabarito: CERTO.
Questão 95
Tendo como referência as informações precedentes e considerando que o zero absoluto é -273,15 K e que a constante dos gases é R 0,082 L ⋅ atm ⋅ K-1 ⋅ mol-1, julgue o item a seguir.
Se os recipientes contêm 4 g de moléculas de oxigênio acondicionadas em 2 L, então, para T = -100 ºC, a pressão será inferior a 1 atm.
- A) Certo
- B) Errado
ESTA QUESTÃO FOI ANULADA, NÃO POSSUI ALTERNATIVA CORRETA
Pessoal, precisamos aplicar
P V = n R T
P V = dfrac{m}{MM} times R times T
P times 4 = dfrac{4}{32} times 0,082 times (273 - 100)
P = 0,39 , atm
Gabarito: ANULADA.
A questão, entretanto, foi ANULADA.
96) Suponha-se que uma típica câmara de ultra-alto-vácuo seja mantida a pressão e temperatura constantes, iguais a 1,38 times 10−8 Pa e 100 K, respectivamente. Nessa situação, considerando-se que k=frac{PV}{NT}=1,38 times 10^{-23}J/K, em que corresponde à pressão, V, ao volume, T, à temperatura e N, à quantidade de moléculas, é correto concluir que a quantidade de moléculas por metro cúbico existentes dentro da câmara é igual a
- A) 4,00 × 106.
- B) 1,00 × 10−13.
- C) 1,00 × 1013.
- D) 1,24 × 10−10.
- E) 1,38 × 10−6.
A alternativa correta é letra C) 1,00 × 1013.
Pessoal, para achar a relação moléculas por volume, precisamos rearranjar a expressão acima.
dfrac{N}{V} = dfrac{P}{kT}
dfrac{N}{V} = dfrac{ 1,38 times 10^{-8}}{1,38 times 10^{-23} times 100}
dfrac{N}{V} = dfrac{ 10^{-8}}{10^{-21}}
dfrac{N}{V} = 10^{13} ,moléculas/m3
Gabarito: LETRA C.
Questão 97
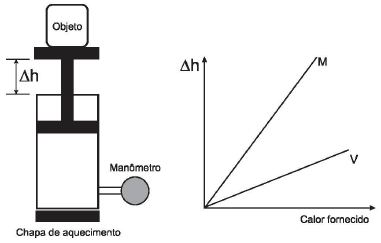
A diferença no comportamento dos gases no experimento decorre do fato de o gás M, em relação ao V, apresentar
- A) maior pressão de vapor.
- B) menor massa molecular.
- C) maior compressibilidade.
- D) menor energia de ativação.
- E) menor capacidade calorífica.
A alternativa correta é letra E) menor capacidade calorífica.
1º PASSO - Utilizando a Equação dos Gases (Equação de Clapeyron), considerando que o volume corresponde à variação de altura multiplicada pela área da base:
P.V=n.R.T
P.Δh.A=n.R.T
Δh=({n.R over P.A}).T
Δh=k.T
2º PASSO - Analisando os gráficos fornecidos pela questão, para a mesma quantidade de calor fornecida, de acordo com o gráfico dado, o valor de Δh é maior para o gás M e, portanto, o gás M atingiu maior temperatura.
3º PASSO - Considerando a fórmula de calorimetria abaixo, percebe-se que, para o mesmo Q, um valor maior de ΔT implica menor valor de C:
Q=m.c.ΔT
CONCLUSÃO: gás M: Δh maior ⇒ ΔT maior ⇒ C menor
OBS.: Se utilizarmos na resolução o Primeiro Princípio da Termodinâmica, o qual diz:
Quantidade de calor é igual a trabalho mais variação de energia interna, chegamos a um resultado incoerente com aquele apresentado acima.
Observa-se que, para a mesma quantidade de calor, o gás M sofre maior variação de altura, realiza um trabalho maior, sofrendo uma variação de energia interna menor, o que implica uma variação de temperatura menor, o que está incoerente com a resolução feita anteriormente. Assim, a questão apresenta dados incompatíveis.
98) Considere a notação: T- temperatura absoluta; v- volume específico molar e P – pressão. Então, para um gás ideal, a expansibilidade, beta = {large{1 over v}} left( {large{ ∂ v over ∂ T}} right)_P, vale:
- A) T
- B) T -1
- C) vT
- D) Pv
A resposta correta é a letra B) $T - 1$. Isso ocorre pois a expansibilidade é definida como a variação relativa do volume em relação à temperatura, mantendo-se a pressão constante. Logo, a expansibilidade pode ser escrita como:
$$beta = frac{1}{v}left(frac{partial v}{partial T}right)_P$$Como o gás é ideal, a equação de estado é dada por $PV = nRT$, onde $n$ é a quantidade de substância e $R$ é a constante dos gases ideais. Portanto, podemos reescrever a equação de estado como:
$$v = frac{nRT}{P}$$Derivando em relação à temperatura, mantendo-se a pressão constante, obtemos:
$$left(frac{partial v}{partial T}right)_P = frac{nR}{P}$$Substituindo essa expressão na fórmula da expansibilidade, obtemos:
$$beta = frac{1}{v}left(frac{nR}{P}right) = frac{nR}{PV} = frac{1}{T}$$Portanto, a expansibilidade é igual a $1/T$. Como $T - 1$ é a única opção que contém a temperatura, a resposta correta é a letra B) $T - 1$.
Questão 99
- A) –18 J
- B) –9,0 J
- C) zero
- D) 9,0 J
- E) 18 J
A alternativa correta é letra A) –18 J
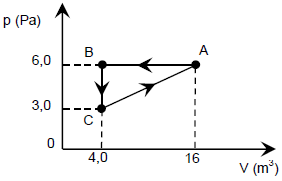
Quando temos um gráfico de pressão em função do volume (mbox{p} times mbox{V}), o trabalho realizado pelo gás no ciclo (large tau) é numericamente igual à área interna à curva que representa o ciclo.
{large{tau}} = mbox{ área}
Se o ciclo é percorrido no sentido horário, o trabalho é positivo, ou seja, o gás realiza trabalho; se o ciclo é percorrido no sentido anti-horário, o trabalho é negativo e o gás neste caso está recebendo trabalho do meio externo.
Analisando o gráfico vemos que o ciclo é percorrido no sentido anti-horário e possui a forma de um triângulo, de base AB e altura BC, logo, o trabalho realizado pelo gás no ciclo ABCA será:
{largetau} = -dfrac{AB times BC}{2}
{largetau} = - dfrac{12 times 3}{2}
bbox[8px, border: 2px solid black]{color{#3498db}{{largetau} = -18mbox{ J}}}
Sendo assim, o trabalho realizado pelo gás no ciclo fechado ABCA é igual a color{#3498db}{-18mbox{ J}}.
100) Uma amostra de um gás ideal sofre uma expansão isobárica. Para que isto ocorra é necessário que essa amostra
- A) não realize trabalho.
- B) permaneça com temperatura constante.
- C) receba calor e cujo valor seja maior que o trabalho realizado.
- D) receba calor e cujo valor seja menor que o trabalho realizado.
Para que uma amostra de um gás ideal sofra uma expansão isobárica, é necessário que essa amostra receba calor e cujo valor seja maior que o trabalho realizado. Isso porque, durante uma expansão isobárica, a pressão do gás permanece constante, e o volume do gás aumenta. Para que isso ocorra, é necessário que o gás absorva calor do meio externo, pois o trabalho realizado pelo gás durante a expansão é menor que o calor absorvido.
Para entender melhor, vamos analisar as outras alternativas:
- A) não realiza trabalho: essa afirmação é falsa, pois durante uma expansão isobárica, o gás realiza trabalho para aumentar seu volume.
- B) permanece com temperatura constante: essa afirmação é falsa, pois durante uma expansão isobárica, a temperatura do gás aumenta, pois o calor absorvido é maior que o trabalho realizado.
- D) recebe calor e cujo valor seja menor que o trabalho realizado: essa afirmação é falsa, pois durante uma expansão isobárica, o calor absorvido é maior que o trabalho realizado.
Portanto, a alternativa correta é C) recebe calor e cujo valor seja maior que o trabalho realizado. Isso porque, durante uma expansão isobárica, o gás absorve calor do meio externo e realiza trabalho para aumentar seu volume, e o valor do calor absorvido é maior que o trabalho realizado.
Matematicamente, podemos representar a expansão isobárica pela equação:
$$W = -P cdot Delta V$$onde $W$ é o trabalho realizado pelo gás, $P$ é a pressão do gás e $Delta V$ é a variação de volume do gás. Como a pressão é constante, o trabalho realizado é menor que o calor absorvido, pois o calor absorvido é igual à variação de energia interna do gás ($Delta U = Q$).
Portanto, a alternativa correta é C) recebe calor e cujo valor seja maior que o trabalho realizado, pois durante uma expansão isobárica, o gás absorve calor do meio externo e realiza trabalho para aumentar seu volume, e o valor do calor absorvido é maior que o trabalho realizado.
