Questões Sobre Termologia - Física - concurso
1001) Considere as informações a seguir para responder à questão.
- A) 12,1
- B) 26,5
- C) 34,0
- D) 40,0
- E) 74,4
A alternativa correta é letra C) 34,0
Pessoal, apesar de fornecer a fórmula dos gases ideais, o que precisamos é a fórmula de variação de pressão e temperatura
(dfrac{P}{T})_{antes} = (dfrac{P}{T})_{depois}
dfrac{30}{27 + 273} = dfrac{P_{depois}}{67 + 273}
P = 34 , Psi
Gabarito: LETRA C.
Questão 1002
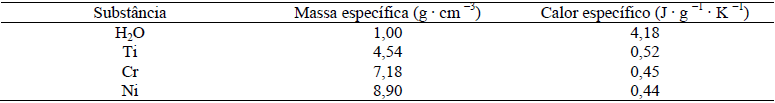
- A) T_{Cr}>T_{Ni}>T_{Ti}
- B) T_{Ni}=T_{Ti}>T_{Cr}
- C) T_{Ni}>T_{Cr}>T_{Ti}
- D) T_{Ti}>T_{Cr}>T_{Ni}
- E) T_{Ti}>T_{Cr}=T_{Ni}
A alternativa correta é letra C) T_{Ni}>T_{Cr}>T_{Ti}
ALTERNATIVA CORRETA: LETRA C
Calcularemos a massa de cada substância, pois temos o valor da massa específica de cada uma e sabendo que o volume é o mesmo e vale:
V=a^3=(2cm)^3=8~{cm}^3
m=V.rho
m_{Cr}=8.7,18=57,44g
m_{Ni}=8.8,90=71,20g
m_{Ti}=8.36,32g
A soma dos calores ao atingir o equilíbrio é igual a zero, e as temperaturas finas das substâncias e da água deverá ser a mesma, faremos o cálculo da temperatura final de cada substância e em seguidas as compararemos:
Para o Cr, temos:
m_{Cr}.C_{p_{Cr}}.Delta T_{Cr} + m_{H_2O}.C_{p_{H_2O}}.Delta T_{H_2O} = 0
57,44.0,45.(T_F-80) + 50.4,18.(T_F-0)=0
25,85.(T_F-80) + 209.(T_F-0)=0
25.85.T_F-2068+209.T_F-2090=0
234,85.T_F-4158=0
T_F=frac{4158}{234,85}=17,70°C=T_{Cr}
Para o Ni, temos:
m_{Ni}.C_{p_{Ni}}.Delta T_{Ni} + m_{H_20}.C_{p_{H_20}}.Delta T_{H_20} = 0
71,20.0,44.(T_F-80) + 50.4,18.(T_F-0)=0
31,33.(T_F-80) + 209.(T_F-0)=0
33,33.T_F-2506+209.T_F-2090=0
240,33.T_F-4596=0
T_F=frac{4596}{240,33}=19,12°C=T_{Ni}
Para o Ti, temos:
m_{Ti}.C_{p_{Ti}}.Delta T_{Ti} + m_{H_20}.C_{p_{H_20}}.Delta T_{H_20} = 0
36,32.0,52.(T_F-80) + 50.4,18.(T_F-0)=0
18,89.(T_F-80) + 209.(T_F-0)=0
18,89.T_F-1511+209.T_F-2090=0
227,89.T_F-3601=0
T_F=frac{3601}{227,89}=15,80°C=T_{Ti}
Com os valores das temperaturas de cada substância, faremos a comparação entre eles:
T_{Ni}~>~T_{Cr}~>~T_{Ti}
ALTERNATIVA CORRETA: LETRA C
1003) Considere um sistema composto por um fluido confinado em um recipiente cilíndrico, que, inicialmente, esteja em determinado estado de equilíbrio termodinâmico. Considere, ainda, que o fluido sofra um processo termodinâmico e volte ao estado inicial e que o processo cíclico seja tal que, ao voltar ao estado inicial, ele realize certo trabalho W > 0. A partir dessas informações, julgue o item que se segue.
- A) Certo
- B) Errado
A alternativa correta é letra B) Errado
A variação da energia interna do gás depende dos estados inicial e final, ou seja:
Delta E_{int} = E_{int}^{final} - E_{int}^{inicial}
Ao voltar ao estado inicial, temos que E_{int}^{final} = E_{int}^{inicial}. Logo,
Delta E_{int} = 0
Portanto, como o fluido volta ao estado inicial, a variação da energia interna é IGUAL que zero.
Resposta: ERRADO.
Questão 1004
Analise a figura abaixo.
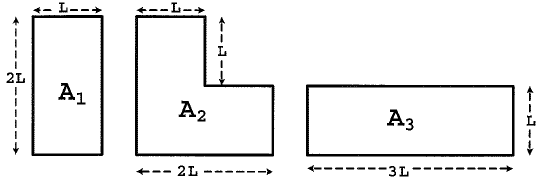
Três placas metálicas retangulares feitas do mesmo material possuem áreas A1, A2 e A3, cujas dimensões estão indicadas na figura acima. Considerando que elas sofrem um aumento de temperatura de mesmo valor, pode-se afirmar que o aumento das áreas das placas, triangle,A_1, triangle,A_2,,e,triangle,A_3 se relacionam por:
- A) triangle,A_1 = triangle,A_2 = triangle,A_3
- B) triangle,A_1 = triangle,A_2,e,triangle,A_1 <triangle,A_3
- C) triangle,A_3 < triangle,A_1< triangle,A_2
- D) triangle,A_1 < triangle,A_2,e,triangle,A_2 = triangle,A_3
- E) triangle,A_2 > triangle,A_3 > triangle,A_1
A alternativa correta é letra D) triangle,A_1 < triangle,A_2,e,triangle,A_2 = triangle,A_3
Pessoal, vamos calcular a área de cada uma delas.
A_1 = 2L times L = 2L^2
A_2 = L times L + L times 2L = 3 L^2
A_3 = 3L^2
Agora, pessoal, reparem que o aumento de área é dado por
Delta A = A alpha Delta T
Como os materiais são os mesmos e a variação de temperatura também, temos que a única influência que diferencia cada dilatação será a área de cada material.
Percebam que elas são diretamente proporcional, quanto maior a área inicial maior a dilatação.
Logo, a primeira área é a que menos vai aumentar e a segunda terá um mesmo aumento que a terceira (visto terem a mesma área 3L2),
triangle,A_1 < triangle,A_2,e,triangle,A_2 = triangle,A_3
Gabarito: LETRA D.
1005) Em um calorímetro (instrumento utilizado em laboratórios de física para estudar trocas de calor), inicialmente com 150g água (calor específico 1,0 frac{cal}{g.ºC}) a uma temperatura de 10 , é colocado um bloco metálico homogêneo, de 200g, e com temperatura de 90 . Considerando que a temperatura de equilíbrio atingida é de 30 . e desprezando a capacidade térmica do calorímetro, qual o calor específico do metal que constitui o bloco?
- A) 0,15 frac{cal}{g.ºC}
- B) 0,25 frac{cal}{g.ºC}
- C) 0,5frac{cal}{g.ºC}
- D) 0,75frac{cal}{g.ºC}
A resposta correta é a letra B) 0,25 cal/g.°C.
Para encontrar o calor específico do metal, precisamos calcular a variação de calor que ocorreu no sistema. Inicialmente, o calorímetro contém 150g de água a 10°C. Em seguida, é colocado um bloco metálico homogêneo de 200g a 90°C. Considerando que a temperatura de equilíbrio atingida é de 30°C, podemos calcular a variação de calor que ocorreu no sistema.
Primeiramente, vamos calcular a variação de calor que ocorreu na água. A variação de calor é dada pela fórmula Q = mcΔT, onde m é a massa da água, c é o calor específico da água (1,0 cal/g.°C) e ΔT é a variação de temperatura. Nesse caso, a variação de temperatura é de 20°C (30°C - 10°C). Portanto, a variação de calor que ocorreu na água é Q = 150g × 1,0 cal/g.°C × 20°C = 3000 cal.
Agora, vamos calcular a variação de calor que ocorreu no bloco metálico. Como a temperatura final é a mesma para ambos os sistemas (30°C), a variação de temperatura do bloco metálico é de 60°C (90°C - 30°C). Seja c o calor específico do metal, então a variação de calor que ocorreu no bloco metálico é Q = 200g × c × 60°C.
Como o sistema está em equilíbrio térmico, a variação de calor que ocorreu na água é igual à variação de calor que ocorreu no bloco metálico. Portanto, podemos igualar as duas expressões: 3000 cal = 200g × c × 60°C. Resolvendo para c, encontramos o calor específico do metal: c = 0,25 cal/g.°C.
Portanto, a resposta correta é a letra B) 0,25 cal/g.°C. Essa é a quantidade de calor necessária para elevar a temperatura de 1g do metal em 1°C.
Questão 1006
Com base nessas informações, julgue o próximo item.
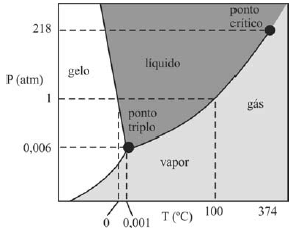
A figura a seguir ilustra uma possível representação do diagrama de fase da água, na qual consta o ponto triplo, região em que ocorrem, simultaneamente, os estados gasoso, líquido e sólido.
- A) Certo
- B) Errado
A resposta certa é A) Certo.
Para entender por que essa é a resposta certa, vamos analisar o problema. Temos 30 g de gelo a 0°C que se transformam em água a 0°C. Isso significa que houve uma mudança de fase do gelo para a água, e para isso, é necessário fornecer calor ao sistema. O calor fornecido é conhecido como calor latente de fusão, que no caso do gelo é de 80 cal/g.
Como a entropia é uma grandeza que mede a desordem ou a aleatoriedade de um sistema, durante a mudança de fase do gelo para a água, a entropia do sistema aumenta, pois as moléculas passam de um estado mais ordenado (sólido) para um estado mais desordenado (líquido). Essa variação de entropia é dada pela fórmula: ΔS = ΔQ / T, em que ΔQ é a quantidade de calor fornecida ao sistema e T é a temperatura em Kelvin.
No caso em questão, como a temperatura é de 0°C (ou 273 K), a variação de entropia pode ser calculada como: ΔS = 80 cal/g * 30 g / 273 K = 87,97 J/K. Ou seja, a variação de entropia do sistema é de aproximadamente 87,97 J/K.
Portanto, como a variação de entropia é uma grandeza importante para descrever o sistema, e não seu valor absoluto, a afirmativa está correta.
É importante notar que o diagrama de fase da água, apresentado na figura, mostra a região em que os estados gasoso, líquido e sólido coexistem, conhecida como ponto triplo. No entanto, isso não é relevante para a resolução do problema.
1007) Uma chapa metálica de dimensões 10 cm :,< 20 cm X 0,5 cm possui um furo no centro, cujo diâmetro é 1,00 cm se a temperatura da chapa é 20°C. O coeficiente linear de dilatação da chapa é de 20 x: 10-6(ºc-1). Se a temperatura da chapa é 520°C, é CORRETO afirmar que a área do furo é
- A) 1 -'i: menor que a 20°c
- B) 1% maior que a 20°c
- C) 2 .."i:: maior que a 20°C
- D) 2% menor que a 20°C
A resposta correta é a letra C) 2 .."i:: maior que a 20°C.
Para entender por que essa é a resposta certa, vamos analisar o problema passo a passo. Primeiramente, precisamos calcular a variação de temperatura da chapa metálica. A temperatura inicial é de 20°C e a temperatura final é de 520°C, portanto, a variação de temperatura é de 500°C.
Em seguida, precisamos calcular a variação da área do furo central da chapa. Para isso, vamos utilizar a fórmula do coeficiente linear de dilatação:
ΔL = α * L0 * ΔT
onde ΔL é a variação do comprimento, α é o coeficiente linear de dilatação, L0 é o comprimento inicial e ΔT é a variação de temperatura.
No nosso caso, precisamos calcular a variação da área do furo, portanto, vamos utilizar a fórmula:
ΔA = 2 * π * r0 * Δr
onde ΔA é a variação da área, r0 é o raio inicial do furo e Δr é a variação do raio.
Como o coeficiente linear de dilatação é de 20 x 10^-6 °C^-1, podemos calcular a variação do raio do furo:
Δr = α * r0 * ΔT = 20 x 10^-6 °C^-1 * 1 cm * 500°C = 0,1 cm
Agora, podemos calcular a variação da área do furo:
ΔA = 2 * π * r0 * Δr = 2 * π * 1 cm * 0,1 cm = 0,628 cm^2
Portanto, a área do furo aumentou em cerca de 2 vezes em relação à área inicial. Isso significa que a área do furo é maior que a área do furo à temperatura de 20°C.
Logo, a resposta correta é a letra C) 2 .."i:: maior que a 20°C.
1008) Um Professor de Ciências realizou um experimento no laboratório com seus alunos utilizando um gás ideal confinado em um cilindro com um êmbolo móvel. Ao aquecer o cilindro com um fogareiro, a classe observou todas as variações causadas no sistema.
- A) ΔP é diretamente proporcional a Delta U e inversamente proporcional a Q.
- B) ΔU é diretamente proporcional a Q, mas não depende de ΔP.
- C) Q é diretamente proporcional a Delta U, e Delta P aumenta se o volume permanecer constante.
- D) ΔP e ΔU são independentes de Q se o volume do gás não mudar.
- E) Q é inversamente proporcional a Delta P e diretamente proporcional a Delta U.
A alternativa correta é letra C) Q é diretamente proporcional a Delta U, e Delta P aumenta se o volume permanecer constante.
Pessoal, a lei que rege o experimento descrito é
Delta U = Q - W
Delta U = Q - P delta V
a) ΔP é diretamente proporcional a Delta U e inversamente proporcional a Q.
ERRADO. É diretamente proporcional a U e a Q.
b) ΔU é diretamente proporcional a Q, mas não depende de ΔP.
ERRADO. A primeira parte está correta. Porém, a segunda erra: a variação de energia depende da pressão.
c) Q é diretamente proporcional a Delta U, e Delta P aumenta se o volume permanecer constante.
CORRETA. Reparem que ao aquecermos, se não variarmos o volume a pressão tem que aumentar.
d) ΔP e ΔU são independentes de Q se o volume do gás não mudar.
ERRADO. São sim dependentes.
e) Q é inversamente proporcional a Delta P e diretamente proporcional a Delta U.
ERRADO. Se Q aumenta P e U aumentam também.
Gabarito: LETRA C.
1009) A temperatura de um sistema, quando medida na escala Celsius, varia obedecendo à seguinte função Tc = 15 t + 10, onde t representa o tempo medido em segundos. A temperatura desse mesmo sistema, sob as mesmas condições, se medida na escala Fahrenheir, sofrerá uma variação cuja função representativa será
- A) TF = 27 t + 50
- B) TF = 30 t - 20
- C) TF = 25 t + 0,35
- D) TF = 20 t - 50
- E) TF = 35 t + 15
A alternativa correta é letra A) TF = 27 t + 50
Resposta: Alternativa A
Segundo a equação fornecida pelo enunciado, a temperatura inicial é 10 ºC e a cada segundo transcorrido a temperatura aumenta 15 ºC. Observe:
T_c = 15 cdot t + 10
t =0 to T_c = 15 cdot 0 + 10 to T_c = 10 mbox{ ºC}
t = 1 to T_c = 15 cdot 1 + 10 to T_c = 25 mbox{ ºC}
t = 1 to T_c = 15 cdot 2 + 10 to T_c = 40 mbox{ ºC}
Para montar a nova equação, faremos:
- a conversão da temperatura inicial para a escala fahrenheit:
{C- 0 over 100 - 0} = {x - 32 over 212 - 32}
{10- 0 over 100 - 0} = {x - 32 over 212 - 32}
0,1 = {x - 32 over 180}
x = 50 mbox{ ºF}
- a conversão da variação de temperatura que ocorre a cada segundo:
Ao comparar as duas escalas acima, podemos perceber que entre o ponto de fusão e ebulição temos uma variação de temperatura de 100º (100 - 0) na escala celsius e de 180º (212 - 32) na escala fahrenheit, logo, podemos montar a seguinte regra de três:
100 mbox{ ºC} to 180 mbox{ ºF}
15 mbox{ ºC} to x mbox{ ºF}
100 cdot x = 15 cdot 180
x = 27 mbox{ ºF}
Portanto, a equação, utilizando a escala Fahrenheit, será:
T_f = 27 cdot t + 50
1010) Um estudante dispõe de uma garrafa de vidro e uma garrafa de alumínio, cada uma contendo 350cm3 de refrigerante, que são mantidas em um refrigerador pelo mesmo período de tempo. Ao retirá-las do refrigerador com as mãos desprotegidas, têm-se a sensação de que a lata está mais fria que a garrafa.
- A) A garrafa e a lata estão à mesma temperatura, possuem a mesma condutividade térmica, e a sensação deve-se à diferença nos calores específicos.
- B) A garrafa e a lata estão à mesma temperatura, e a sensação é devida ao fato de a condutividade térmica do vidro ser maior que a do alumínio.
- C) A garrafa e a lata estão à mesma temperatura, e a sensação é devida ao fato de a condutividade térmica do alumínio ser maior que a do vidro.
- D) A lata está de fato menos fria que a garrafa, pois o vidro possui condutividade térmica menor que a do alumínio.
- E) A lata está realmente menos fria, pois a capacidade calorífica da garrafa é maior que a da lata.
A alternativa correta é letra C) A garrafa e a lata estão à mesma temperatura, e a sensação é devida ao fato de a condutividade térmica do alumínio ser maior que a do vidro.
Por terem sido mantidas em um refrigerador pelo mesmo período de tempo, a garrafa e a lata estarão à mesma temperatura, se o tempo for suficiente para atingir o equilíbrio térmico para ambas garrafas.
A sensação de que a lata está mais fria, é devido à condutividade térmica do alumínio ser maior do que a do vidro. Isso faz com que o calor seja transferido mais rápido para a mão do estudante, gerando a sensação de mais frio.
Portanto, a alternativa correta é a letra (c).
