Questões Sobre Termologia - Física - concurso
1051) Considere que, para aquecer 100 litros de água, de uma temperatura inicial de 10 ºC para uma temperatura de 50 ºC, tenha sido utilizado um dispositivo com potência igual a 1.000 W. Considere, ainda, que a densidade da água seja igual a 1.000 kg/m3 e que 1 caloria seja igual a 4,2 joules. Nessa situação, o tempo gasto, em minutos, para realizar esse procedimento corresponde, aproximadamente, a
- A) 320.
- B) 380.
- C) 150.
- D) 180.
- E) 280.
A resposta correta é a letra E) 280 minutos.
Para calcular o tempo gasto para aquecer 100 litros de água de 10°C para 50°C, devemos considerar a quantidade de calor necessária para isso. Primeiramente, calculamos a variação de temperatura em kelvin (K): ΔT = 50°C - 10°C = 40°C = 40 K.
Em seguida, calculamos a energia necessária para aquecer a água, utilizando a fórmula: Q = mcΔT, onde m é a massa da água, c é o calor específico da água (aproximadamente 4200 J/kg°C) e ΔT é a variação de temperatura.
Como a densidade da água é de 1000 kg/m³, a massa de 100 litros de água é de 100 kg. Substituindo os valores, obtemos:
Q = 100 kg x 4200 J/kg°C x 40°C = 16800000 J
Como a potência do dispositivo é de 1000 W, o tempo necessário para fornecer essa quantidade de energia é:
t = Q / P = 16800000 J / 1000 W = 16800 s
Convertendo o tempo para minutos, obtemos:
t ≈ 16800 s / 60 = 280 minutos
Portanto, a resposta correta é a letra E) 280 minutos.
1052) Ao se mergulhar um bloco de gelo de 100 g, a temperatura de -10 ºC, em 1 kg de água, a uma temperatura de 5 ºC, a temperatura final de equilíbrio será igual a
- A) -0,5 ºC.
- B) 1,5 ºC.
- C) 0 ºC.
- D) 2 ºC .
- E) 0,8 ºC.
A resposta correta é a letra C) 0 °C.
Para explicar essa resposta, vamos analisar o processo de mudança de estado do gelo. Quando o bloco de gelo de 100 g a -10 °C é mergulhado em 1 kg de água a 5 °C, ocorre uma transferência de calor da água para o gelo. O gelo começa a absorver calor da água e a aumentar sua temperatura.
Como a temperatura inicial do gelo é de -10 °C e a temperatura da água é de 5 °C, o gelo irá absorver calor até que sua temperatura atinja 0 °C, ponto de fusão do gelo. Nesse processo, o gelo irá fundir completamente e a temperatura da água irá diminuir.
Após a completa fusão do gelo, a temperatura da água irá continuar a diminuir até que o sistema atinja o equilíbrio térmico. Nesse ponto, a temperatura da água e do gelo fundido será a mesma.
Como a quantidade de calor necessária para fundir completamente o gelo é fornecida pela água, a temperatura final de equilíbrio será inferior à temperatura inicial da água. No entanto, como a quantidade de água é muito maior que a quantidade de gelo, a temperatura final de equilíbrio será muito próxima de 0 °C.
Portanto, a resposta correta é a letra C) 0 °C.
1053) Considerando-se a seguinte relação entre a temperatura em graus Kelvin e a temperatura em gruas Celsius: TK = Tc + 273, é correto afirmar que o aumento percentual da energia cinética média de translação das moléculas de um gás ideal, quando a temperatura deste aumenta de 0 ºC para 100 ºC, é aproximadamente igual, em porcentagem, a
- A) 43,7.
- B) 36,6.
- C) 50,7.
- D) 20,4.
- E) 15,8.
Para responder essa questão, vamos analisar a relação entre a temperatura em graus Kelvin (TK) e a temperatura em graus Celsius (Tc), que é dada pela fórmula: TK = Tc + 273.
Em seguida, vamos considerar a mudança na temperatura de 0°C para 100°C. Para encontrar o aumento percentual da energia cinética média de translação das moléculas de um gás ideal, vamos utilizar a fórmula: Ec = (3/2)kT, onde k é a constante de Boltzmann.
Substituindo os valores, podemos calcular o aumento percentual da energia cinética média:
$$frac{Delta E_c}{E_c} = frac{E_c(100°C) - E_c(0°C)}{E_c(0°C)} = frac{(3/2)k(373K) - (3/2)k(273K)}{(3/2)k(273K)} = frac{373 - 273}{273} = frac{100}{273} approx 36,6%$$
Portanto, o aumento percentual da energia cinética média de translação das moléculas de um gás ideal, quando a temperatura aumenta de 0°C para 100°C, é aproximadamente igual a 36,6%.
Logo, a alternativa correta é a letra B) 36,6.
1054) Em uma casa moram quatro pessoas que utilizam um sistema de placas coletoras de um aquecedor solar para aquecimento da água. O sistema eleva a temperatura da água de 20° C para 60°C todos os dias.
- A) 2,0 m2
- B) 4,0 m2
- C) 6,0 m2
- D) 14,0 m2
- E) 16,0 m2
Para encontrar a área da superfície das placas coletoras, calor necessária para atender à demanda diária de água quente da casa, devemos calcular a quantidade de calor necessária para elevar a temperatura da água de 20°C para 60°C.
Primeiramente, vamos calcular a quantidade total de água quente consumida por dia:
4 pessoas x 80 L/persona = 320 L/dia
Em seguida, vamos calcular a variação de temperatura da água:
ΔT = 60°C - 20°C = 40°C
Agora, vamos calcular a energia necessária para elevar a temperatura da água:
Energia = massa x calor específico x variação de temperatura
Energia = 320 kg x 4,2 J/g°C x 40°C = 53.760 J
Como a eficiência do sistema é de 50%, a energia necessária para elevar a temperatura da água é:
Energia = 53.760 J / 0,5 = 107.520 J
Agora, vamos calcular a área da superfície das placas coletoras necessária para fornecer essa energia:
A área da superfície das placas coletoras é diretamente proporcional à quantidade de calor recebida do sol. Como a placa do aquecedor recebe 2,016 x 10^8 J/m² em um mês, podemos calcular a área necessária:
Área = Energia / (2,016 x 10^8 J/m² x 30 dias)
Área = 107.520 J / (2,016 x 10^8 J/m² x 30)
Área = 16,0 m²
Portanto, a alternativa correta é a letra E) 16,0 m².
Essa área de 16,0 m² é necessária para que as placas coletoras do aquecedor solar forneçam a energia necessária para elevar a temperatura da água de 20°C para 60°C, atendendo à demanda diária de água quente da casa.
1055) Um turista desembarcando em Nova York constatou no aeroporto que a temperatura era de aproximadamente 46,4 ºF. Qual seria a temperatura se a leitura fosse feita na escala Celsius?
- A) 6 ºC
- B) 3 ºC
- C) 8 ºC
- D) 4 ºC
- E) 2 ºC
A alternativa correta é letra C) 8 ºC
Gabarito: LETRA C
A relação entra as escalas Celsius e Fahrenheit, é dada por:
frac{T_C}{5}=frac{T_F-32}{9}
Substituindo a temperatura de 46,4 ºF, na equação, temos:
frac{T_C}{5}=frac{46,4-32}{9}
frac{T_C}{5}=1,6
T_C = 5 times 1,6=8°C
Gabarito: LETRA C
1056) Ao derramar 100 cm3 de café a 80 ºC num copo de leite morno a 40 ºC, obtêm-se 200 cm de café com leite, cuja temperatura aproximada será de:
- A) 70 ºC
- B) 68 ºC
- C) 50 ºC
- D) 49 ºC
- E) 60 ºC
A alternativa correta é letra E) 60 ºC
Gabarito: LETRA E
Levando em conta os princípios da transferência de calor, temos que o corpo de maior temperatura fornecerá calor para o de menor temperatura até que o equilíbrio térmico seja estabelecido.
Vamos considerar que o café e o leite tem aproximadamente os valores de densidade e calor específico da água, devido a quantidade dessa substância em cada um desses líquidos.
Assim temos:
m_{café}=100g
m_{leite}=100g, pois a soma dos dois foi 200cm^3 de volume, que corresponde à 200g.
C_p=1g/cal.°C
Q_{café}+Q_{leite}=0
m_{café}.C_P.(T_{final-café}-T_{inicial-café})+m_{leite}.C_P.(T_{final-leite}-T_{inicial-leite})=0
onde,
T_{final-café}=T_{final-leite}=T_{equilíbrio}=T
100.1.(T-80)+100.1.(T-40)=0
100T-8000+100T-4000=0
200T=12000
T = frac{12000}{200}=60°C
Gabarito: LETRA E
1057) Uma certa quantidade de gelo, no seu ponto de fusão, é misturado com 30 g de vapor d’água no intuito de produzir água líquida a 50ºC. Considerando L=539 cal/g e c=1,00 cal/g.K , a energia necessária, para que isso aconteça, é igual a
- A) 14680 cal.
- B) 15430 cal.
- C) 16460 cal.
- D) 17670 cal.
- E) 18000 cal.
ESTA QUESTÃO FOI ANULADA, NÃO POSSUI ALTERNATIVA CORRETA
Pessoal, reparem que temos que a energia recebida pelo gelo será a energia doada pelo vapor.
Trabalhando apenas com os dados de vapor conseguimos chegar ao resultado.
Vamos aplica "Q MaCeTe".
Q = mL + m c Delta T
Q = 30 times 539 + 30 times 1 times 50
Q = 17.670 , cal
A questão, entretanto, foi anulada.
Gabarito: ANULADA.
1058) Um sistema é constituído por uma pequena esfera metálica e pela água contida em um reservatório. Na tabela, estão apresentados dados das partes do sistema, antes de a esfera ser inteiramente submersa na água.
- A) 20
- B) 30
- C) 40
- D) 50
A alternativa correta é letra B) 30
Gabarito: LETRA B.
Sabemos que a capacidade térmica é dada pela relação entre o calor transferido e a variação da temperatura, como nos mostra a equação a seguir:
C = dfrac Q { Delta T }
Então, temos que:
Q = C cdot Delta T
Supondo que o sistema seja termicamente isolado, o calor cedido pela esfera é igual ao calor absorvido pela água do reservatório, Assim, temos
C_{esfera} cdot Delta T_{esfera} = C_{água} cdot Delta T_{água}
Sendo T_E a temperatura de equilíbrio, podemos reescrever a equação acima da seguinte maneira:
C_{esfera} cdot left( T_{E} - T_{esfera_0} right)= C_{água} cdot left( T_{água_0} - T_{E} right)
Substituindo os valores da tabela, temos
2 cdot left( T_{E} - 50 right)= 2000 cdot left( 30 - T_{E} right)
2 T_{E} - 1000 = 60000 - 2000 T_{E}
2002 T_{E} = 61000
T_E approx 30 °C
Portanto, a resposta correta é a alternativa (b).
Questão 1059
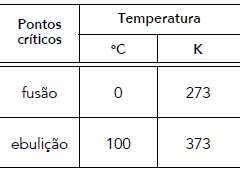
Considere que, no intervalo de temperatura entre os pontos críticos do gelo e da água, o mercúrio em um termômetro apresenta uma dilatação linear.
Nesse termômetro, o valor na escala Celsius correspondente à temperatura de 313 K é igual a:
- A) 20
- B) 30
- C) 40
- D) 60
A alternativa correta é letra C) 40
Gabarito: LETRA C.
A relação entre a temperatura T_C em celsius e a temperatura T_K em kelvins é dada por:
T_C = T_K - 273
Então, o valor na escala Celsius correspondente à temperatura de 313 K é
T_C = 313 - 273
T_C = 40°C
Portanto, a resposta correta é a alternativa (c).
1060) Com relação às leis da termodinâmica, assinale a opção correta.
- A) Se dois objetos estão em equilíbrio térmico com um terceiro objeto, não necessariamente eles estarão em equilíbrio térmico entre si.
- B) Processos adiabáticos são aqueles nos quais nenhum aqueles nos quais nenhum trabalho é realizado.
- C) A variação da energia interna de um gás ideal depende da variação de temperatura do gás e do tipo de processo responsável pela variação da temperatura.
- D) Se um processo irreversível ocorre em um sistema fechado, a entropia do sistema permanece constante, pois a entropia nunca diminui.
- E) Todas as máquinas de Carnot, quando funcionam entre as mesmas temperaturas Tquente e Ttrio, possuem eficiência, idêntica, independentemente da substância de trabalho.
A alternativa correta é letra E) Todas as máquinas de Carnot, quando funcionam entre as mesmas temperaturas Tquente e Ttrio, possuem eficiência, idêntica, independentemente da substância de trabalho.
Vamos verificar afirmativa por afirmativa, pessoal.
a) Se dois objetos estão em equilíbrio térmico com um terceiro objeto, não necessariamente eles estarão em equilíbrio térmico entre si. ERRADO. Se estão em equilíbrio térmico entre si, possuem a mesma temperatura (sem fluxo de calor). Logo, também terão a mesma temperatura com um terceiro.
b) Processos adiabáticos são aqueles nos quais nenhum aqueles nos quais nenhum trabalho é realizado. ERRADO. Nenhuma troca de calor é realizada.
c) A variação da energia interna de um gás ideal depende da variação de temperatura do gás e do tipo de processo responsável pela variação da temperatura. ERRADO. Não depende do tipo de processo e, sim, do estado inicial e final (o trajeto não é importante).
d) Se um processo irreversível ocorre em um sistema fechado, a entropia do sistema permanece constante, pois a entropia nunca diminui. ERRADO. Pessoal, a regra natural é a entropia diminuir.
e) Todas as máquinas de Carnot, quando funcionam entre as mesmas temperaturas Tquente e Ttrio, possuem eficiência, idêntica, independentemente da substância de trabalho. CORRETA. Realmente ela não depende da substância pessoal e sim, das temperaturas da fonte quente e da fonte fria.
N = 1 - dfrac{T_F}{T_Q}
Gabarito: LETRA E.
