Questões Sobre Termologia - Física - concurso
1071) O calor específico de uma substância é a quantidade de calor necessária para:
- A) Elevar-se de 1º a temperatura de toda a massa do corpo feito desta substância.
- B) Efetuar a fusão de uma unidade de massa desta substância.
- C) Efetuar a fusão de toda a massa desta substância.
- D) Elevar-se de 1º a temperatura de uma unidade de massa desta substância.
- E) Elevar de 100º a temperatura de 1 Kg de água pura.
Resposta: A alternativa correta é D) Elevar-se de 1°C a temperatura de uma unidade de massa desta substância.
Para entender por que essa é a resposta correta, é preciso compreender o que é calor específico. O calor específico de uma substância é a quantidade de calor necessária para elevar a temperatura de uma unidade de massa dessa substância em 1°C. Ou seja, é a quantidade de calor que uma substância absorve ou libera quando sua temperatura aumenta ou diminui em 1°C.
Portanto, a resposta D) está correta porque o calor específico é justamente a quantidade de calor necessária para elevar a temperatura de uma unidade de massa da substância em 1°C.
Já as outras alternativas estão incorretas porque:
- A) Elevar-se de 1°C a temperatura de toda a massa do corpo feito desta substância é uma afirmação genérica que não define o que é calor específico.
- B) Efetuar a fusão de uma unidade de massa desta substância é uma mudança de estado de agregação que não tem relação direta com o calor específico.
- C) Efetuar a fusão de toda a massa desta substância é uma mudança de estado de agregação que também não tem relação direta com o calor específico.
- E) Elevar de 100°C a temperatura de 1 kg de água pura é uma afirmação que não define o que é calor específico e, além disso, apresenta uma unidade de massa específica (1 kg) que não é característica do calor específico.
Em resumo, o calor específico é a quantidade de calor necessária para elevar a temperatura de uma unidade de massa da substância em 1°C, o que é exatamente a resposta D).
1072)
- A) 4
- B) 12
- C) 18
- D) 36
- E) 60
A alternativa correta é letra B) 12
Inicialmente vamos calcular a quantidade de energia total (Q_T) que foi conduzida através da placa durante o tempo Delta t = 1mbox{ min} = 60,s . Utilizando a equação da condutividade térmica, temos:
Phi = dfrac{Q}{Delta t} = dfrac{k cdot A cdot Delta theta}{e}
Q_T = dfrac{k cdot A cdot Delta theta cdot Delta t}{e}
Substituindo os dados:
Q_T=dfrac{50 cdot 0,6 cdot (195-175) cdot 60}{0,3}
bbox[8px, border: 1px solid black]{color{black}{Q_T= 120 , 000,J}}
Agora devemos calcular a quantidade de calor que foi absorvida pela peça (Q), porém não sabemos a variação de temperatura sofrida pela peça. Para calcularmos a variação de temperatura sofrida pela peça (Delta theta_p) podemos utilizar a equação da dilatação volumétrica.
Delta V = gamma cdot V_0 cdot Delta theta_p tag{1}
Como a peça sofreu uma variação de volume de 1%, podemos escrever que:
dfrac{Delta V}{V_0} = 1% = dfrac{1}{100}
Passando o termo (V_0) para o primeiro membro da Equação (1), obtemos o porcentual de dilatação volumétrica:
dfrac{Delta V}{ V_0} = gamma cdot Delta theta_p tag{2}
O coeficiente de dilatação volumétrico (gamma) pode ser escrito como:
gamma = 3 cdot alpha
Onde (alpha) é o coeficiente de dilatação volumétrica. Calculando (gamma), temos:
gamma = 3 cdot 1,6 times 10^{-5}
bbox[8px, border: 1px solid black]{color{black}{gamma = 4,8 times 10^{-5}, ^circ C^{-1}}}
Retornando à Equação (2) e substituindo os valores obtidos:
dfrac{Delta V}{ V_0} = gamma cdot Delta theta_p
dfrac{1}{100} = 4,8 times 10^{-5} cdot Delta theta_p
Delta theta_p = dfrac{1}{100 times 4,8 times 10^{-5}}= dfrac{1}{ 4,8 times 10^{-3}}
bbox[8px, border: 1px solid black]{color{black}{Delta theta_p = dfrac{1,000}{4,8} ,^circ C}}
O termo (Delta theta_p) foi deixado em fração pois ainda será utilizado em outros cálculos. Agora podemos aplicar a equação de calor sensível para calcular o calor absorvido pela peça.
Q = m cdot c cdot Delta theta_p
Q = 0,16 cdot 432 cdot dfrac{1,000}{4,8}= dfrac{0,16 cdot 432 cdot 1,000}{4,8}
bbox[8px, border: 1px solid black]{color{black}{Q=14,400 , J}}
Finalmente calculando a fração (F) que a energia absorvida pela peça (Q) representa da energia total (Q_T) temos:
F = dfrac{Q}{Q_T} = dfrac{14,400}{120,000}= dfrac{144cancel{00}}{1200cancel{00}}=dfrac{144}{1,200}
F=dfrac{cancelto{12}{144}}{cancelto{100}{1200}}=dfrac{12}{100}
bbox[8px, border: 2px solid #3498db]{color{#3498db}{F = 12, %}}
Portanto a fração de energia, em percentagem, efetivamente utilizada para deformar a peça foi de 12 %.
Questão 1073
Com base nessas informações, julgue o próximo item.
A figura a seguir ilustra uma possível representação do diagrama de fase da água, na qual consta o ponto triplo, região em que ocorrem, simultaneamente, os estados gasoso, líquido e sólido.
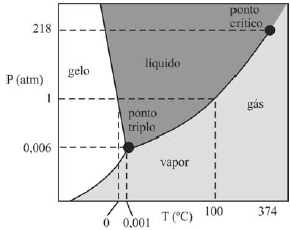
- A) Certo
- B) Errado
A resposta certa é a letra A) Certo.
Essa afirmação está relacionada à variação da entropia em um sistema durante um processo físico. A entropia é uma grandeza termodinâmica que mede o grau de desordem ou aleatoriedade de um sistema. Durante um processo reversível, a variação da entropia (ΔS) está relacionada à quantidade de calor adicionado ao sistema (ΔQ) e à temperatura (T) em que ocorre o processo, segundo a fórmula:
$$Delta S = frac{Delta Q}{T}$$
No caso do problema, temos 30 g de gelo que se transformam em água a 0°C. Para isso, é necessário fornecer ao sistema uma quantidade de calor igual ao calor latente de fusão do gelo, que é de 80 cal/g. Logo, a quantidade total de calor fornecida é de:
$$Delta Q = 30 times 80 = 2400 text{ cal}$$
Como a temperatura é constante e igual a 0°C (ou 273 K), podemos calcular a variação da entropia:
$$Delta S = frac{Delta Q}{T} = frac{2400}{273} approx 8,79 frac{text{cal}}{text{K}}$$
Portanto, a afirmativa está correta, pois a informação mais importante sobre o processo é a variação da entropia, e não o seu valor absoluto.
1074) O Grau Celsius (ºC) é a unidade padrão para medida de temperatura no Brasil, porém existem outras unidades que também podem ser utilizadas. Por exemplo:
- A) Rankine.
- B) Grau Celsius.
- C) Kelvin.
- D) Grau Fahrenheit.
- E) Réaumur.
A resposta certa é a letra C) Kelvin.
Para entender porque, vamos analisar a fórmula dada: °C = "X" - 273,15. Nessa fórmula, "X" representa a temperatura em uma unidade de medida específica.
O grau Celsius (°C) é a unidade padrão de medida de temperatura no Brasil, mas existem outras unidades que também podem ser utilizadas. As opções apresentadas são:
- A) Rankine: é uma unidade de medida de temperatura utilizada em alguns países, especialmente nos Estados Unidos, mas não é a mais comum no Brasil.
- B) Grau Celsius: é a unidade padrão de medida de temperatura no Brasil, mas não é a resposta certa nesse caso, pois a fórmula dada não é uma definição de grau Celsius.
- C) Kelvin: é a unidade de medida de temperatura no Sistema Internacional de Unidades (SI) e é relacionada ao grau Celsius pela fórmula dada: °C = K - 273,15. Portanto, "X" na fórmula representa a temperatura em Kelvin.
- D) Grau Fahrenheit: é uma unidade de medida de temperatura utilizada em alguns países, especialmente nos Estados Unidos, mas não é a mais comum no Brasil e não é relacionada à fórmula dada.
- E) Réaumur: é uma unidade de medida de temperatura obsoleta, que não é mais utilizada.
Portanto, a resposta certa é a letra C) Kelvin, pois a fórmula dada é uma definição da temperatura em Kelvin em relação ao grau Celsius.
1075) Vamos considerar dois recipientes nos quais o primeiro contém 2 mols de He (hélio) e o segundo contém 2 mols de Ar (argônio). A pressão nos dois recipientes é idêntica e os respectivos gases ocupam volumes iguais. A massa molecular do hélio é igual a 4 e a massa molecular do argônio é igual a 40. Assinale a alternativa correta.
- A) A temperatura do recipiente que contém o gás hélio é maior do que a temperatura do recipiente que contém o gás argônio.
- B) A temperatura do recipiente que contém o gás hélio é menor do que a temperatura do recipiente que contém o gás argônio.
- C) O número de moléculas de argônio é diferente do número de moléculas de hélio, o que nos impede de ter uma conclusão em relação à temperatura.
- D) As temperaturas nos dois recipientes são idênticas.
- E) A energia cinética média por molécula do recipiente que contém hélio é menor que a do recipiente que contém argônio.
A alternativa correta é letra D) As temperaturas nos dois recipientes são idênticas.
A questão cobra o conhecimento do aluno da fórmula
PV = nRT
Reparem que temos 2 mols de gás em cada um dos recipientes, mesma pressão e mesmo volume.
Analisando alternativa por alternativa agora
a) A temperatura do recipiente que contém o gás hélio é maior do que a temperatura do recipiente que contém o gás argônio.
ERRADO. A temperatura vai ser igual, pois todos os parâmetros da equação acima são iguais (lembrar que R é uma constante e também é igual para os dois casos).
b) A temperatura do recipiente que contém o gás hélio é menor do que a temperatura do recipiente que contém o gás argônio.
ERRADO. Conforme explicado na alternativa A.
c) O número de moléculas de argônio é diferente do número de moléculas de hélio, o que nos impede de ter uma conclusão em relação à temperatura.
ERRADO. Sabemos o número de mols n e isso é o suficiente para verificarmos as afirmativas.
d) As temperaturas nos dois recipientes são idênticas.
CORRETO. Conforme explicado na alternativa A. Reparem que mesmo sendo gases distintos, a mesma quantia de mols que interessa para verificarmos a relação PV = nRT.
e) A energia cinética média por molécula do recipiente que contém hélio é menor que a do recipiente que contém argônio.
ERRADO. Visto que a temperatura são iguais, a energia cinética média por molécula também são iguais. Lembremos que a temperatura pode ser definida como o grau de agitação das moléculas.
Questão 1076
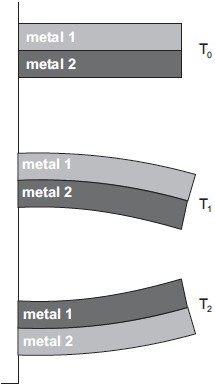
Se as composições dos metais 1 e 2 forem, respectivamente,
Use para coeficiente de dilatação térmica linear:
aço = 1,20 x 10-5 oC-1
cobre = 1,70 x 10-5 oC-1
níquel = 1,30 x 10-5 oC-1
latão = 1,80 x 10-5 oC-1
- A) aço e cobre, então T1 > T2
- B) cobre e níquel, então T1 < T2
- C) aço e níquel, então T1 > T2
- D) aço e latão, então T1 > T2
- E) níquel e latão, então T1 < T2
A alternativa correta é letra E) níquel e latão, então T1 < T2
Pessoal, aquela que tem o maior coeficiente de dilatação é aquela que "dilata mais".
Na prática, a que dilata mais acaba "abraçando por fora" aquela que dilata menos quando aumentamos a temperatura.
Quando diminuímos a temperatura, a que dilata menos irá "abraçar por fora".
O coeficiente de dilatação é a sensibilidade a mudança de tamanho conforme a temperatura muda.
Sendo assim, a conjuntura que faz sentido é a da alternativa E.
Veja que o latão dilata mais que o níquel (maior coeficiente).
Logo, para uma temperatura 1 menor que a temperatura 2, teremos que o níquel vai "abraçar por fora" o latão, pois o latão encolheu mais.
Na temperatura 2, por sua vez, o latão vai "abraçar por fora" pois a temperatura é maior que em 1 (ele dilatou mais).
Gabarito: LETRA E.
1077) Em uma garrafa térmica, são misturadas quantidades iguais de café quente e leite frio.
- A) A troca de calor entre o café e o leite irá cessar.
- B) A troca de temperatura entre o café e o leite irá cessar.
- C) A temperatura do café será igual ao calor contido no leite.
- D) O café e o leite atingirão o calor latente.
- E) O calor contido no leite será igual ao calor contido no café.
A alternativa correta é letra A) A troca de calor entre o café e o leite irá cessar.
Pessoal, clássica questão de termodinâmica que tenta avaliar o que o aluno sabe sobre os conceitos de temperatura, calor, equilíbrio, etc.
Quando temos um sistema em equilíbrio térmico, temos que não há mais troca de calor entre eles (LETRA A).
Isso ocorre porque ambos se encontram em mesma temperatura, de forma que a o calor cessa.
Q = m c Delta T
Q = m c times 0 = 0
b) A troca de temperatura entre o café e o leite irá cessar.
ERRADA. O termo troca de temperatura não existe. O que troca/flui é calor/energia.
c) A temperatura do café será igual ao calor contido no leite.
ERRADA. É a temperatura dos dois que irá se igualar.
d) O café e o leite atingirão o calor latente.
ERRADA. Calor latente é uma característica do material, e não algo a se atingir.
e) O calor contido no leite será igual ao calor contido no café.
ERRADA. A temperatura será igual. O leite, por ter maior calor específico, terá mais calor retido dentro de si provavelmente por ser mais gorduroso (embora o termo "calor retido" seja tecnicamente estranho).
Gabarito: LETRA A.
1078) Um técnico de laboratório brasileiro precisa enviar o valor do calor específico de um metal para seu colega norte-americano, o qual utiliza a caloria como unidade de energia, a libra (Pound) como unidade de massa (1 lb = 450 g), e o grau Fahrenheit como unidade de temperatura. Se o calor específico do referido metal é de 0,25 cal/(g.oC), seu correspondente valor em cal/(lb.oF) é
- A) 405,0.
- B) 202,5.
- C) 62,5.
- D) 457,5.
- E) 625,0.
Resposta: B) 202,5.
Para encontrar o valor do calor específico do metal em cal/(lb.°F), precisamos converter as unidades de massa e temperatura.
Primeiramente, vamos converter a unidade de massa de gramas (g) para libras (lb). Sabemos que 1 lb é igual a 450 g, então:
$$1 frac{g}{cal} times frac{1 lb}{450 g} = 0,0022 frac{lb}{cal}$$
Agora, vamos converter a unidade de temperatura de graus Celsius (°C) para graus Fahrenheit (°F). A fórmula de conversão é:
$$°F = °C times frac{9}{5} + 32$$
Portanto, o calor específico do metal em cal/(g.°C) é de 0,25. Para convertê-lo para cal/(lb.°F), multiplicamos pela razão de conversão de massa e temperatura:
$$0,25 frac{cal}{g.°C} times frac{1}{0,0022 frac{lb}{cal}} times frac{5}{9} = 202,5 frac{cal}{lb.°F}$$
Portanto, a resposta correta é B) 202,5.
1079) Para medir temperaturas, o técnico de um laboratório dispunha apenas de um termômetro graduado na escala Fahrenheit e precisava realizar uma operação envolvendo trocas de calor. Verteu, então, 300 mL de água a 35 ºF para o interior de um calorímetro, de capacidade térmica desprezível e, uma vez isolado o sistema do meio ambiente, fez atingir a temperatura de 125 ºF, após fornecer-lhe uma quantidade de calor Q. O calor específico da água foi considerado constante e com o valor 1,0 cal∕(g.ºC); a densidade da água é de 1,0 g⁄mL.
- A) 18 000.
- B) 16 000.
- C) 15 000.
- D) 14 000.
- E) 20 000.
A resposta correta é a letra C) 15 000.
Para explicar essa resposta, vamos analisar o problema passo a passo. Temos 300 mL de água à temperatura de 35°F que precisam ser aquecidos até 125°F. A capacidade térmica do calorímetro é desprezível, o que significa que não absorve calor significativo. Além disso, o sistema está isolado do meio ambiente, o que significa que não há perda de calor.
Podemos aplicar a fórmula de calor específico para calcular a quantidade de calor necessário para elevar a temperatura da água:
$$Q = m cdot c cdot Delta T$$
Onde $Q$ é a quantidade de calor, $m$ é a massa da água, $c$ é o calor específico da água e $Delta T$ é a variação de temperatura.
Primeiramente, precisamos converter a temperatura inicial e final de Fahrenheit para Celsius:
$$T_i = 35°F = 1,67°C$$
$$T_f = 125°F = 51,67°C$$
Agora, podemos calcular a variação de temperatura:
$$Delta T = T_f - T_i = 51,67°C - 1,67°C = 50°C$$
A massa da água é de 300 mL, que é igual a 300 g, pois a densidade da água é de 1 g/mL. Substituindo os valores na fórmula de calor específico, temos:
$$Q = 300 g cdot 1,0 frac{cal}{g°C} cdot 50°C = 15 000 cal$$
Portanto, a quantidade de calor necessária para elevar a temperatura da água de 35°F para 125°F é de 15 000 cal.
1080) Uma chapa metálica de dimensões 10 cm :,< 20 cm X 0,5 cm possui um furo no centro, cujo diâmetro é 1,00 cm se a temperatura da chapa é 20°C. O coeficiente linear de dilatação da chapa é de 20 x: 10-6(ºc-1). Se a temperatura da chapa é 520°C, é CORRETO afirmar que a área do furo é
- A) 1 -'i: menor que a 20°c
- B) 1% maior que a 20°c
- C) 2 .."i:: maior que a 20°C
- D) 2% menor que a 20°C
A resposta certa é a letra C)
Vamos analisar a situação apresentada. Temos uma chapa metálica com dimensões 10 cm × 20 cm × 0,5 cm, com um furo no centro de diâmetro 1,00 cm. A temperatura da chapa é de 20°C. O coeficiente linear de dilatação da chapa é de 20 × 10^(-6) °C^(-1).
Queremos saber como varia a área do furo se a temperatura da chapa aumenta para 520°C. Para isso, precisamos calcular a variação do diâmetro do furo em função da temperatura.
A fórmula para calcular a variação do comprimento de um material em função da temperatura é:
ΔL = α × L × ΔT
Onde ΔL é a variação do comprimento, α é o coeficiente linear de dilatação, L é o comprimento inicial e ΔT é a variação de temperatura.
No nosso caso, queremos calcular a variação do diâmetro do furo, então:
Δd = α × d × ΔT
Onde d é o diâmetro inicial do furo.
Substituindo os valores, temos:
Δd = 20 × 10^(-6) °C^(-1) × 1,00 cm × (520°C - 20°C)
Δd ≈ 0,198 cm
O diâmetro do furo aumentou em aproximadamente 0,198 cm.
Agora, podemos calcular a área do furo em função do diâmetro:
A = π × (d/2)^2
Substituindo o novo diâmetro do furo, temos:
A ≈ π × (1,198 cm / 2)^2
A ≈ 1,26 cm^2
A área do furo aumentou em aproximadamente 26% em relação à temperatura de 20°C.
Portanto, a alternativa correta é a letra C) 2 .."i: maior que a 20°C.
