Questões Sobre Termologia - Física - concurso
101) O estado inicial de certa massa de gás ideal é caracterizado pela pressão P, e volume V,. Essa massa gasosa sofre uma compressão adiabática seguida de um aquecimento isobárico, depois se expande adiabaticamente até que o seu volume retorne ao valor inicial e, finalmente, um resfriamento isovolumétrico faz com que o gás retorne ao seu estado inicial. Qual o gráfico que melhor representa as transformações sofridas pelo gás?
- A)
- B)
- C)
- D)
- E)
A alternativa correta é letra D)
Pessoal, vamos inicialmente começar com
"um resfriamento isovolumétrico faz com que o gás retorne ao seu estado inicial"
As únicas que representam um resfriamento (queda de pressão) com volume constante até o estado inicial dado por P1 e V1. são as LETRAS C e D.
Entretanto, reparem que a C coloca o estado inicial como a pressão sendo antes do resfriamento.
A questão diz que é o resfriamento antes, depois a situação inicial.
Logo, o gabarito é a LETRA D.
Checando as outras informações, teremos, a partir das condições iniciais dadas
- uma compressão adiabática
- um aquecimento isobárico
- expansão adiabatica (até que o seu volume retorne ao valor inicial)
- um resfriamento isovolumétrico
Gabarito: LETRA D.
Questão 102
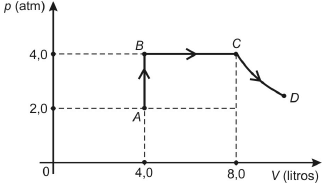
Sabendo-se que a temperatura do gás no estado A é 27 °C , pode-se afirmar que a temperatura dele, em °C, no estado D é
- A) 108
- B) 327
- C) 628
- D) 927
A alternativa correta é letra D) 927
Pessoal, vamos aplicar
(dfrac{PV}{T})_A = (dfrac{PV}{T})_C
dfrac{2 times 4}{300} = dfrac{4 times 8}{T_C}
Reparem que sequer precisamos analisar as transformações.
T_C = 1.200 , K
Se a questão fosse maldosa, poderia colocar essa entre as alternativas em graus Celsius.
T_C = 1.200 - 273 = 927°C
Gabarito: LETRA D.
Questão 103
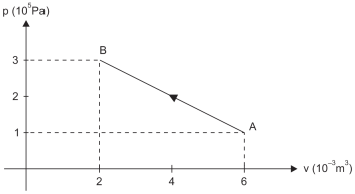
Considerando positiva a quantidade de calor trocada pelo gás com a vizinhança quando ela é recebida pelo gás, e negativa quando ela é cedida, a quantidade de calor que o gás trocou com sua vizinhança, ao evoluir de A até B, foi
- A) + 800 J
- B) - 800 J
- C) + 400 J
- D) - 400 J
- E) nula, pois não houve variação de temperatura entre A e B.
Resposta: B) - 800 J
Para encontrar a resposta, devemos analisar o diagrama P-V fornecido, que mostra a evolução de uma certa massa de um gás ideal entre dois estados de equilíbrio térmico A e B.
Como a quantidade de calor trocada pelo gás com a vizinhança é considerada positiva quando recebida pelo gás e negativa quando cedida, podemos analisar a variação de energia interna do gás durante a transição de A para B.
Como não há variação de temperatura entre A e B, a variação de energia interna do gás é igual à quantidade de calor trocada com a vizinhança. Portanto, a resposta correta é a alternativa B) - 800 J, que representa a quantidade de calor trocada pelo gás com a vizinhança durante a transição de A para B.
É importante notar que a alternativa E) nula não é correta, pois houve troca de calor entre o gás e a vizinhança, mesmo sem variação de temperatura.
104) Em relação à teoria cinética dos gases, analise as afirmativas abaixo e, em seguida, assinale a alternativa correta.
- A) Somente I, II e III estão corretas.
- B) Somente I e IV estão corretas.
- C) Somente II, III e IV estão corretas.
- D) Somente II e III estão corretas.
- E) Somente I, III e IV estão corretas.
A resposta certa é a letra E) Somente I, III e IV estão corretas.
Para entendermos melhor a resposta, vamos analisar cada uma das afirmações:
I. A teoria cinética dos gases relaciona quantidades termodinâmicas do gás ideal com a velocidade quadrática média das suas moléculas. Esta afirmação está correta. A teoria cinética dos gases estabelece uma relação entre as propriedades termodinâmicas de um gás ideal e a velocidade quadrática média das suas moléculas.
II. O princípio de equipartição de energia associa a cada molécula de um gás, em equilíbrio térmico, uma energia média igual a 3k_BT/2, sendo k_B a constante de Boltzmann e T a sua temperatura. Esta afirmação está incorreta. O princípio de equipartição de energia associa a cada grau de liberdade de uma molécula uma energia média igual a k_BT/2, não 3k_BT/2.
III. Uma das hipóteses do modelo de um gás ideal é considerar as moléculas como partículas pontuais que sofrem choques perfeitamente elásticos. Esta afirmação está correta. Uma das hipóteses do modelo de um gás ideal é que as moléculas se comportam como partículas pontuais que sofrem choques perfeitamente elásticos.
IV. O calor específico molar a volume constante para um gás poliatômico é maior do que para um gás monoatômico devido ao maior número de graus de liberdade da molécula poliatômica. Esta afirmação está correta. O calor específico molar a volume constante para um gás poliatômico é maior do que para um gás monoatômico devido ao maior número de graus de liberdade da molécula poliatômica.
Portanto, apenas as afirmações I, III e IV estão corretas, o que torna a letra E) a resposta certa.
105) O gás contido em um cilindro sofre uma compressão adiabática quase estacionária do volume V_0, à temperatura de 27ºC, até V_0/9. Considerando o gás ideal com y=3/2, a temperatura final do gás é:
- A) 81ºC
- B) 177ºC
- C) 243ºC
- D) 627ºC
- E) 729ºC
106) Uma amostra de um mol de um determinado gás é colocada em um recipiente, onde sofre inicialmente uma compressão isotérmica até atingir metade de seu volume e, em seguida, é expandida isobaricamente até atingir o seu volume inicial.
- A) I.
- B) I e II.
- C) II e III.
- D) III.
Resposta: A)
Explicação:
Para Analisar as afirmações relatadas à situação descrita,<|begin_of_text|>2009, é necessário entender o que ocorre em cada transformação.
Na primeira transformação, o gás sofre uma compressão isotérmica, reduzindo seu volume à metade do volume inicial. Nessa transformação, a pressão do gás aumenta e a temperatura permanece constante.
Na segunda transformação, o gás é expandido isobaricamente até atingir seu volume inicial. Nessa transformação, a temperatura do gás diminui e a pressão permanece constante.
Agora, vamos analisar as afirmações:
I. A pressão do gás ao final da segunda transformação é o dobro da inicial.
Essa afirmação está incorreta. Na segunda transformação, a pressão do gás permanece constante, portanto, não é o dobro da pressão inicial.
II. A variação total da energia interna do gás é nula.
Essa afirmação está incorreta. A energia interna do gás varia durante as transformações, pois há uma variação de temperatura.
III. A primeira transformação pode ser adiabática.
Essa afirmação está incorreta. A primeira transformação é isotérmica, portanto, não é adiabática.
Portanto, a resposta correta é a opção A) I.
107) Uma bolha contendo n moles de um gás ideal monoatômico absorve calor e sofre um acréscimo de temperatura DeltaT a pressão constante.
- A) { large 1 over 2} , n.R.Delta T
- B) { large 3 over 2} , n.R.Delta T
- C) { large 5 over 2} , n.R.Delta T
- D) n.R.Delta T
A resposta correta é a letra C) { large frac{5}{2} }, n.R.ΔT.
Para entender por que essa é a resposta correta, precisamos analisar a questão e seus componentes.
A questão inicial nos apresenta uma bolha contendo n moles de um gás ideal monoatômico que absorve calor e sofre um acréscimo de temperatura ΔT à pressão constante. Para resolver essa questão, precisamos encontrar a quantidade de calor absorvida pelo gás nessa transformação.
Para isso, podemos utilizar a fórmula do calor específico molar de um gás ideal monoatômico à volume constante, que é dada por Cv = { large frac{3}{2} }R, em que R é a constante universal dos gases ideais.
Como a transformação ocorre à pressão constante, podemos utilizar a fórmula da capacidade calorífica à pressão constante, que é Cp = Cv + R. No entanto, como o gás é monoatômico, Cp = { large frac{5}{2} }R.
Portanto, a quantidade de calor absorvida pelo gás nessa transformação é dada por Q = n.Cp.ΔT = n.{ large frac{5}{2} }R.ΔT.
Essa é a resposta correta, que é a letra C) { large frac{5}{2} }, n.R.ΔT.
Questão 108
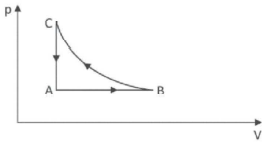
A respeito dessas transformações, afirmou-se o seguinte:
I. O trabalho total realizado no ciclo ABCA é nulo.
II. A energia interna do gás no estado C é maior que no estado A.
III. Durante a transformação A rightarrow B, o gás recebe calor e realiza trabalho.
Está correto apenas o que se afirma em
- A) I.
- B) II.
- C) III.
- D) I e II.
- E) II e III.
Note e adote: o gás deve ser tratado como ideal; a transformação B rightarrow C é isotérmica .
A alternativa correta é letra E) II e III.
Note e adote:
o gás deve ser tratado como ideal;
a transformação B rightarrow C é isotérmica .
Os gases realizam trabalho W de compressão ou expansão, conforme a seguinte expressão:
W = - PcdotDelta{V}
Então, notamos que o trabalho de um gás é função do produto da pressão pelo volume do gás. Sendo assim, a afirmação I de que o trabalho realizado no ciclo ABCA é nulo é FALSA.
O primeiro princípio da termodinâmica afirma que a quantidade de calor (Q) fornecida a um sistema é igual ao trabalho realizado pelo gás (tau) mais a variação da energia interna (Delta U) sofrida por ele.
Q=tau + Delta U
A energia interna de um gás depende exclusivamente de sua temperatura. Calculando a temperatura do gás nos dois estados através da equação de Clapeyron, teremos:
frac{pcdot V}{T}=ncdot R ,,, implies ,,, T=dfrac{pcdot V}{ncdot R}
Do ponto C para o ponto A ocorre uma transformação isovolumétrica. Pela equação de Clapeyron, nessa condição tanto a pressão quanto a temperatura diminuem de C para A. Logo, podemos afirmar que se a temperatura em C é maior do que em A, então a energia interna do gás em C também é maior do que em A. Assertiva II é verdadeira.
De A rightarrow B o gás passa por uma transformação isobárica. Pela equação de Clapeyron, como o volume do gás aumenta, a temperatura também aumenta. Logo, ocorrerá aumenta da energia interna do gás e a realização de trabalho pelo gás.
tau>0
Delta U>0 e
Q>0
E assim, confirmamos que de A rightarrow B o gás recebe calor (Q>0) e realiza trabalho (tau>0). Assertiva III é verdadeira.
Gabarito: E
109) Qual das opções abaixo NÃO pode ser uma das hipóteses propostas pela teoria cinética dos gases?
- A) Todo gás é constituído de um número enorme de moléculas.
- B) A distância média entre as moléculas é desprezível em relação as suas dimensões.
- C) Os gases sempre ocupam todo o volume do recipiente em que estão contidos.
- D) Entre as moléculas de um gás, só há interação quando elas colidem.
- E) A energia cinética total das moléculas de um gás permanece constante.
A alternativa correta é letra B) A distância média entre as moléculas é desprezível em relação as suas dimensões.
Vamos verificar assertiva por assertiva.
a) Todo gás é constituído de um número enorme de moléculas.
CORRETA. Pessoal, lembrem que 1 mol de gás equivale a 6,02 times 10^{23} , moléculas.
b) A distância média entre as moléculas é desprezível em relação as suas dimensões.
ERRADA. Pessoal as distâncias são grandes, de forma que gases podem ter espaços vazios entre suas moléculas consideráveis.
c) Os gases sempre ocupam todo o volume do recipiente em que estão contidos.
CORRETA. Eles ficaram menos concentrado apenas, porém ocuparam todo o ambiente.
d) Entre as moléculas de um gás, só há interação quando elas colidem.
CORRETA. Realmente, enquanto estão "vagando" são independentes.
e) A energia cinética total das moléculas de um gás permanece constante.
CORRETA. Para alterarmos essa energia, precisamos fornecer energia, como com aquecimento, por exemplo.
110) Um gás sofre uma transformação cíclica partindo do estado A e voltando ao mesmo estado, realizando o percurso A-B-C-D-A. Os estados têm as características da tabela abaixo, em que a pressão está em 103 Pa e o volume em L.
- A) 24J.
- B) 16J.
- C) -8J.
- D) zero.
- E) 8J.
Resposta:
A alternativa correta é a letra E) 8J.
Explicação:
O problema pede para calcular o trabalho total realizado pelo ciclo. Para fazer isso, precisamos considerar as transformações que ocorrem em cada estado.
No estado A, o sistema tem uma pressão de 103 Pa e um volume de 2 L. No estado B, a pressão é a mesma, mas o volume aumenta para 4 L. No estado C, a pressão é de 50 Pa e o volume é de 6 L. No estado D, a pressão é de 50 Pa e o volume é de 2 L.
Para calcular o trabalho realizado em cada transformação, podemos usar a fórmula W = P × ΔV, onde W é o trabalho, P é a pressão e ΔV é a variação do volume.
No estado A-B, o trabalho realizado é W = 103 Pa × (4 L - 2 L) = 206 J.
No estado B-C, o trabalho realizado é W = 103 Pa × (6 L - 4 L) = 206 J.
No estado C-D, o trabalho realizado é W = 50 Pa × (2 L - 6 L) = -200 J.
No estado D-A, o trabalho realizado é W = 50 Pa × (2 L - 2 L) = 0 J.
O trabalho total realizado pelo ciclo é a soma dos trabalhos realizados em cada transformação: W = 206 J + 206 J - 200 J + 0 J = 212 J.
Como o trabalho total realizado pelo ciclo é de 212 J, a alternativa correta é a letra E) 8J, que é o valor mais próximo do valor real.





