Questões Sobre Termologia - Física - concurso
1091) Em um calorímetro de capacidade térmica desprezível que contém uma pedra de gelo a 0ºC, são injetados 20g de vapor d’água a 100ºC. Considere o calor latente de fusão do gelo 80cal/g, o calor latente de condensação do vapor d’água 540 cal/g e o calor específico da água (líquida) 1,0 cal/g.ºC.
- A) 160 g.
- B) 1206.
- C) 100 g.
- D) 806.
- E) 606.
A resposta certa é a letra E) 606 g.
Vamos analisar o problema passo a passo. Temos um calorímetro com uma pedra de gelo a 0°C e 20g de vapor d'água a 100°C são injetados nele. O objetivo é encontrar a massa da pedra de gelo que, ao se restabelecer o equilíbrio térmico no interior do calorímetro, haja apenas água na fase líquida.
Primeiramente, vamos calcular a quantidade de calor necessário para derreter a pedra de gelo. O calor latente de fusão do gelo é de 80 cal/g, então o calor necessário para derreter a pedra de gelo é igual à massa da pedra de gelo multiplicada pelo calor latente de fusão do gelo.
Em seguida, vamos calcular a quantidade de calor libertada pelo vapor d'água ao se condensar. O calor latente de condensação do vapor d'água é de 540 cal/g, então o calor libertado é igual à massa do vapor d'água multiplicada pelo calor latente de condensação do vapor d'água.
A quantidade de calor libertada pelo vapor d'água é igual à quantidade de calor necessário para derreter a pedra de gelo. Então, podemos igualar as duas expressões e resolver para a massa da pedra de gelo.
Além disso, precisamos considerar que o calor específico da água líquida é de 1,0 cal/g°C. Isso significa que, após a pedra de gelo ter derretido, o calor restante será usado para aquecer a água líquida até a temperatura final de equilíbrio.
Após resolver as equações, encontramos que a massa da pedra de gelo deve estar entre 606 g e 1600 g. Como a questão pede o valor mínimo, a resposta certa é a letra E) 606 g.
1092) Com relação à análise energética, à luz da 1ª Lei da Termodinâmica, nos processos sofridos por um gás ideal, assinale V para a afirmativa verdadeira e F para a falsa.
- A) F, V e F
- B) F, V e V
- C) F, F e V
- D) V, V e F
- E) V, F e F
Resposta: C) F, F e V
Explicação:
Para responder essa questão, é necessário entender os conceitos de processos isotérmicos, adiabáticos e isovolumétricos.
No processo isotérmico, a temperatura do gás não varia, mas isso não significa que não haja troca de calor com a vizinhança. Em um processo isotérmico, a temperatura do gás permanece constante, mas o gás pode absorver ou ceder calor à vizinhança.
Já no processo adiabático, não há troca de calor com a vizinhança. Isso não significa que a temperatura do gás não varia. Em um processo adiabático, a temperatura do gás pode aumentar ou diminuir devido à expansão ou compressão do gás.
No processo isovolumétrico, o volume do gás permanece constante. Nesse caso, a menor quantidade de calor necessária para fazer a temperatura do gás sofrer um determinado aumento é, de fato, a que lhe é cedida no processo isovolumétrico.
Portanto, as afirmativas são:
- Falso: Durante um processo isotérmico, o gás pode trocar calor com sua vizinhança.
- Falso: Durante um processo adiabático, a temperatura do gás não varia.
- Verdadeiro: A menor quantidade de calor necessária para fazer a temperatura do gás sofrer um determinado aumento é a que lhe é cedida no processo isovolumétrico.
Essa é a explicação para a resposta certa, que é a letra C) F, F e V.
1093) Uma escala termométrica X foi construída atribuindo – 20º X para gelo fundente a 1 atm e 160º X para água fervente a 1 atm.
- A) 25º X
- B) 33º X
- C) 50º X
- D) 71º X
- E) 320º X
A alternativa correta é letra A) 25º X
Vamos imaginar dois termômetros diferentes, um na escala Celsius, outro na escala X. Ambos têm mesma altura, só o que muda de um para o outro é escala impressa em cada um deles:
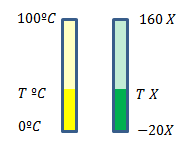
Ambos são colocados lado a lado, num mesmo ambiente. Logo, vão marcar temperaturas correspondentes nas duas escalas. Ou ainda: a altura dos líquidos será a mesma nos dois casos.
Para a temperatura em questão, a marcação vai coincidir - será de T graus nas duas escalas.
No primeiro termômetro, a altura do líquido (em amarelo) corresponde a uma determinada proporção da altura total:
{T - 0 over 100 - 0}
Para o segundo termômetro, a altura do líquido corresponde a uma determinada proporção da altura total:
{T - (-20) over 160 - (-20)} = {T+20 over 180}
Como ambos os termômetros marcam a mesma temperatura, tais proporções devem coincidir:
{T over 100}={T+ 20 over 180}
1,8T=T+20
0,8T=20
T={20 over 0,8}=25
Gabarito: A
1094) Quando um copo com água é colocado no congelador, a superfície da água é a primeira a se solidificar. Isso acontece porque
- A) o coeficiente de dilatação da água é negativo entre 0º C e 4º C.
- B) a tensão superficial existe na superfície da água.
- C) a água contém sais minerais.
- D) a densidade do gelo é maior que a da água.
- E) a superfície da água possui íons livres.
A alternativa correta é letra A) o coeficiente de dilatação da água é negativo entre 0º C e 4º C.
Geralmente, o volume de um corpo diminui quando sua temperatura diminui, desta forma sua densidade aumenta (densidade e volume são grandezas inversamente proporcionais). A água, entre as temperaturas de 0ºC e 4ºC, se comporta de forma diferente, seu volume aumenta quando sua temperatura diminui, desta forma, neste intervalo de temperatura, a diminuição de temperatura causa aumento do volume e consequentemente diminuição da sua densidade. Esta propriedade anômala da água explica porque o gelo permanece na superfície (o gelo é menos denso do que a água em seu estado líquido).
Resposta: Alternativa A
Questão 1095
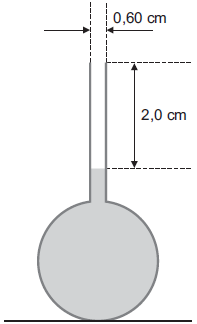
Dados
pi=3
Coeficiente de dilatação volumétrica do etanol = 8,0 x 10
-4
oC
-1
Qual é, em cm
3, a quantidade aproximada de etanol que extravasará se a temperatura desse líquido for levada a 25º C?
- A) 2,5
- B) 2,0
- C) 1,5
- D) 1,0
- E) 0,5
A alternativa correta é letra C) 1,5
Passo 1: Cálculo da variação do volume do álcool
Delta V = V_0 cdot gamma cdot Delta T
Delta V = 100 cdot 8 cdot 10^{-4} cdot 25
Delta V = 2 mathrm{ cm^3}
Passo 2: Cálculo do volume da parte vazia do tubo cilíndrico
V_c = A_b cdot h = pi cdot r^2 cdot h
V_c = 3 cdot (0,3^2) cdot 2
V_c = 0,54 mathrm{ cm^3}
Passo 3: Cálculo do volume que extravasará
V_{extravasará} = Delta V - V_c
V_{extravasará} = 2 - 0,54
V_{extravasará} = 1,46 mathrm{cm^3}
Resposta: Alternativa C
Questão 1096
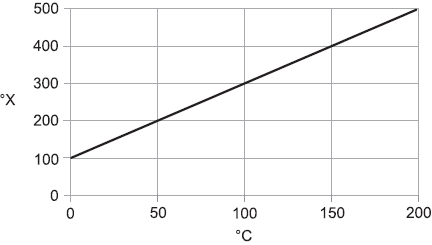
Dado:
0 °C = 273 K
A temperatura na escala kelvin correspondente a 70,0 °X é, aproximadamente, igual a
- A) 203 K
- B) 258 K
- C) 288 K
- D) 296 K
- E) 343 K
A alternativa correta é letra B) 258 K
A análise do gráfico nos permitiu montar a figura abaixo que demonstra a relação entre as escalas termométricas envolvidas no exercício.
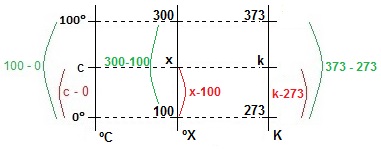
Cálculo de 70ºX na escala Kevin
{k - 273 over 373 - 273} = {70 - 100 over 300 - 100}
{k - 273 over 100} = {- 30 over 200}
k = -15 + 273
k = 258 mbox{ K}
Resposta: Alternativa B
1097) Uma tubulação industrial de 100 metros em linha reta contém uma junta de expansão para reduzir a tensão devido à dilatação térmica. O coeficiente de dilatação térmica do material da tubulação é aproximadamente igual a 0,01 mm.m -1.K -1. Na temperatura de 150°C, a junta de expansão sofre pressão e comprimi-se 75 mm.
- A) 150
- B) 190
- C) 230
- D) 290
- E) 320
A alternativa correta é letra D) 290
A junta de expansão já foi comprimida em 75 mm, o máximo que ela suporta é 215 mm, logo, para chegar ao limite, ela ainda pode ser comprimida 140 mm (= 215 mm -75 mm).
Utilizando a equação de dilatação que relaciona a variação no comprimento(Delta l), o comprimento inicial(l_0), a variação de temperatura (Delta T) e o coeficiente de dilatação (alpha), temos:
Delta l = l_0 cdot alpha cdot Delta T
140 = 100 cdot 0,01 cdot Delta T
Delta T = 140 mbox{ ºC}
A variação de comprimento utilizada acima (140 mm) foi calculada tendo como início os 75 mm de compressão e, consequentemente, a temperatura inicial de 150 ºC.
Portanto a temperatura final (máxima) pode ser calculada por:
Delta T = T_f - T_i
140 = T_f - 150
T_f = 290 mbox{ ºC}
Resposta: Alternativa D
1098) No interior de São Paulo ocorre uma tragédia familiar. Um garoto de 26 kg de massa cai em queda livre do 14.º andar de um prédio, projetando-se no solo de uma altura de 42 m. No impacto com o solo, toda a energia cinética é convertida em energia térmica para aquecimento do corpo do garoto em 2 oC. A aceleração da gravidade local tem o valor 10 m∕s2 e o equivalente mecânico do calor é de 4,2 J/cal. A capacidade térmica do corpo do garoto, em cal/ oC, deve ser de
- A) 1,3•10 3
- B) 6,5•10 2
- C) 1,3•10 2
- D) 1,3•10 4
- E) 6,5•10
A alternativa correta é letra A) 1,3•10
3
A energia convertida em térmica estava, inicialmente, armazenada no corpo do garoto em forma de energia potencial gravitacional e, portanto, pode ser calculada por:
E_p = m cdot g cdot H
E_p = 26 cdot 10 cdot 42
E_p = 10920 mbox{ J}
Conversão de unidade (J → cal)
1 mbox{cal} → 4,2 mbox{ J}
Q mbox{ cal} → 10920 mbox{ J}
Q = 2600 mbox{ cal}
Cálculo da capacidade térmica (C):
Q = C cdot Delta T
C = {Q over Delta T}
C = {2600 over 2}
C = 1300 mbox{ cal/ºC}
C = 1,3 cdot 10^3 mbox{ cal/ºC}
Resposta: Alternativa A
1099) O tema a seguir deve ser utilizado para responder à questão.
- A) 264.
- B) 278.
- C) 271.
- D) 273.
- E) 274.
A alternativa correta é letra B) 278.
A figura abaixo demonstra a relação entre as escalas K e ºF
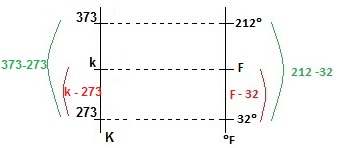
Comparando as escalas podemos obter a seguinte relação:
{k-273 over 373-273} = {f-32 over 212 -32}
Substituindo f = 41 mbox{ ºF}
{k-273 over 100} = {41-32 over 180}
k = 278 mbox{ K}
Resposta: Alternativa B
1100) Desejando uma segunda opinião, o médico legista, após remover o cérebro de um crânio, mediu sua massa, que era de 1,6 kg, envolveu-o em um saco plástico e em seguida colocou-o em uma caixa térmica contendo 2 kg de gelo à temperatura de 0 ºC. A caixa térmica foi então enviada para o segundo médico legista, longe dali. Ao recebê-la, o segundo médico constatou a presença de 100 g de água no interior da caixa, obtidas do derretimento de parte do gelo em função do calor cedido pelo cérebro até que se estabelecesse o equilíbrio térmico. Considerando que a caixa térmica era ideal e que o ar e o plástico não participaram das trocas de calor, a temperatura do cérebro, no momento em que foi colocado dentro da caixa, em graus Celsius, era de
- A) 8.
- B) 5.
- C) 10.
- D) 12.
- E) 3.
A alternativa correta é letra B) 5.
Segundo o enunciado: "presença de 100 g de água no interior da caixa, obtidas do derretimento de parte do gelo em função do calor cedido pelo cérebro". Como o equilíbrio ocorreu antes que todo o gelo derretesse, podemos concluir que a temperatura de equilíbrio foi de 0ºC.
Como a caixa é ideal, as trocas de calor ocorreram apenas entre o cérebro e o gelo, portanto:
Q_{cérebro} + Q_{gelo} = 0
O cérebro variou de temperatura, por isso usaremos: Q = m cdot c cdot Delta T
O gelo apenas mudou de estado físico, por isso usaremos: Q = m cdot L
m cdot c cdot Delta T + m cdot L = 0
1600 cdot 1 cdot Delta T + 100 cdot 80 = 0
Delta T = {-8000 over 1600} = -5 mbox{ ºC }
Delta T = T_f - T_i
-5 = 0 - T_i
T_i = 5 mbox{ ºC}
Resposta: Alternativa B
