Questões Sobre Termologia - Física - concurso
Questão 1131
A tabela a seguir apresenta algumas propriedades de metais que poderiam substituir o cobre:
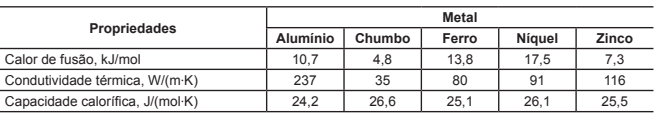
De acordo com as propriedades dos metais listadas na tabela, o melhor metal para substituir o cobre seria o
- A) alumínio.
- B) chumbo.
- C) ferro.
- D) níquel.
- E) zinco.
A alternativa correta é letra A) alumínio.
Inicialmente, faz-se de suma importância apresentar o conceito de cada propriedade da tabela:
Calor de fusão é a quantidade de energia térmica necessária para alterar o estado da matéria de uma substância de um sólido para um líquido.
Condutividade Térmica quantifica a habilidade dos materiais de conduzir calor. Materiais com alta condutividade térmica conduzem calor de forma mais rápida que os materiais com baixa condutividade térmica. Desta maneira, materiais de com alta condutividade térmica são utilizados como dissipadores de calor e materiais de baixa condutividade térmica são utilizados como isolamentos térmicos.
Capacidade Calorífica de um material é a quantidade de calor necessária para elevar a sua temperatura de 1ºC (ou 1ºK); é uma grandeza independente da quantidade de material.
Diante do exposto, percebe-se que a questão requisita um substituto para o cobre considerando a sua CAPACIDADE DE CONDUÇÃO TÉRMICA, ou seja, deve-se buscar o material com a propriedade de MAIOR Condutividade Térmica.
Portanto, o material com a maior condutividade térmica é o Alumínio.
1132) No dia 01 de Janeiro de 2014, ao passear pela praia de Santos-SP, um casal de namorados observa que o céu está muito azul e percebem que a areia da praia está muito quente, porém a água do mar está muito fria. Eles comentam entre si que na noite anterior, quanto estavam festejando o ano novo, perceberam justamente ao contrário, ou seja, a que a areia da praia estava fira e a água do mar estava morna.
- A) Refere-se ao calor específico das substâncias, ou seja, o calor específico da areia é menor que o calor específico da água
- B) Refere-se à densidade das substâncias, ou seja, a densidade da água do mar é menor que a densidade da areia.
- C) Refere-se ao coeficiente de dilatação, ou seja, o coeficiente de dilatação térmica da água é maior que o coeficiente de dilatação térmica da areia.
- D) Refere-se ao calor contido na areia, que à noite propaga-se para a água do mar.
A alternativa correta é letra A) Refere-se ao calor específico das substâncias, ou seja, o calor específico da areia é menor que o calor específico da água.
A explicação para essa resposta está relacionada à capacidade das substâncias em absorver calor. O calor específico é a quantidade de calor necessária para elevar a temperatura de uma substância em 1°C. No caso da areia e da água, a areia tem um calor específico menor que a água.
Isso significa que, para elevar a temperatura da areia em 1°C, é necessário uma quantidade menor de calor do que para elevar a temperatura da água em 1°C. Portanto, quando o casal observa que a areia está muito quente e a água do mar está muito fria, isso se deve ao fato de que a areia absorveu mais rapidamente o calor do sol do que a água do mar.
Além disso, é importante notar que a areia tem uma capacidade de condução de calor menor que a água, o que significa que o calor absorvido pela areia não é facilmente transferido para a água do mar. Isso ajuda a explicar por que a água do mar permaneceu fria mesmo após a areia ter absorvido o calor do sol.
Já na noite anterior, quando o casal observou que a areia estava fria e a água do mar estava morna, isso se deve ao fato de que a areia perdeu calor mais rapidamente que a água do mar. Isso ocorre porque a areia tem uma capacidade de armazenamento de calor menor que a água do mar.
Portanto, a alternativa correta é a letra A, que refere-se ao calor específico das substâncias. Essa é a razão pela qual a areia e a água do mar se comportam de maneira diferente em relação ao calor.
1133) É comum as pessoas tomarem café quente aos golinhos, para não queimarem a boca. Uma quantidade maior de café pode levar a pessoa a ter queimaduras que podem levar dias para deixarem de ser sentidas.
- A) o mesmo calor específico, mas a capacidade térmica de pequenas quantidades de café é menor.
- B) o mesmo calor específico, mas a capacidade térmica de pequenas quantidades de café é maior.
- C) a mesma capacidade térmica, mas o calor específico de pequenas quantidades de café é menor.
- D) a mesma capacidade térmica, mas o calor específico de pequenas quantidades de café é maior.
A alternativa correta é letra A) o mesmo calor específico, mas a capacidade térmica de pequenas quantidades de café é menor.
A base do café é a água. Por isso, poderíamos dizer que o calor específico do café seja aproximadamente igual ao da água. Mas o que é calor específico?
Calor específico é a quantidade de energia necessária para aumentar (ou diminuir) uma unidade de massa de uma substância em um grau de temperatura.
Portanto, quanto maior for a quantidade de café, mais energia térmica será necessário fornecer a ele para que haja elevação de temperatura em, por exemplo, 1 grau de temperatura, pois a quantidade de energia a ser fornecida dependerá da massa da substância. Por outro lado, menores quantidades necessitam de menor quantidade de energia.
Sendo assim, analisemos as alternativas:
Comparando grandes e pequenas quantidades de café, podemos chegar à conclusão que ambas têm
a) o mesmo calor específico, mas a capacidade térmica de pequenas quantidades de café é menor. Essa é a resposta!
b) o mesmo calor específico, mas a capacidade térmica de pequenas quantidades de café é maior. Falso, pois seria a capacidade térmica de pequenas quantidades seria menor.
c) a mesma capacidade térmica, mas o calor específico de pequenas quantidades de café é menor. Falso, pois o calor específico é o mesmo, não importa se pequena ou grande quantidade.
d) a mesma capacidade térmica, mas o calor específico de pequenas quantidades de café é maior. Falso. Idem letra C.
Gabarito: Letra A.
1134) A partir da expressão de dilatação linear ( Δell = α ⋅ ell 0 ⋅ΔT ), pode-se dizer que o coeficiente de dilatação linear (α) pode possuir como unidade
- A) ºC
- B) { large m over ºC}
- C) ºC^{-1}
- D) { large ºC over m}.
Questão de Física sobre o assunto "Termologia".
A resposta correta é a letra C) °C^(-1).
Para entender por quê, vamos analisar a expressão de dilatação linear: ΔL = α * L0 * ΔT. Nessa expressão, α é o coeficiente de dilatação linear, L0 é o comprimento inicial e ΔT é a variação de temperatura.
O coeficiente de dilatação linear (α) é uma grandeza que mede a variação do comprimento de um material em relação à variação de temperatura. Sua unidade, portanto, deve ser uma razão entre uma unidade de comprimento e uma unidade de temperatura.
Analizando as alternativas, podemos ver que:
- A) °C não é uma razão entre uma unidade de comprimento e uma unidade de temperatura, então não é a unidade correta.
- B) {m / °C} não é uma unidade adequada, pois o coeficiente de dilatação linear não é uma razão entre uma unidade de massa e uma unidade de temperatura.
- C) °C^(-1) é a unidade correta, pois é uma razão entre uma unidade de temperatura (°C) e uma unidade adimensional (ou seja, uma razão entre uma unidade de comprimento e uma unidade de comprimento, que é adimensional).
- D) {°C / m} não é uma unidade adequada, pois o coeficiente de dilatação linear não é uma razão entre uma unidade de temperatura e uma unidade de comprimento.
Portanto, a alternativa correta é a letra C) °C^(-1), que é a unidade adequada para o coeficiente de dilatação linear.
Questão 1135
Considerando:
-massa de A = mA;
-massa de B = mB;
-calor específico de A = cA;
-calor específico de B = cB.
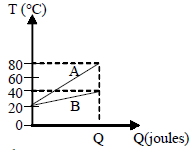
Pode-se dizer que { large m_A c_A over m_B c_B} é igual a
- A) 1/3.
- B) 1/2.
- C) 2.
- D) 3.
Resposta: A) 1/3.
Para entender por que a alternativa correta é A) 1/3, vamos analisar as informações fornecidas no problema. Temos dois líquidos, A e B, com massas mA e mB, respectivamente, e calores específicos cA e cB, respectivamente. Além disso, sabemos que ambos os líquidos absorvem a mesma quantidade de calor, Q.
Quando um líquido absorve calor, sua temperatura aumenta. A variação de temperatura (ΔT) é diretamente proporcional à quantidade de calor absorvido (Q) e inversamente proporcional à massa do líquido (m) e ao seu calor específico (c). Matematicamente, isso pode ser representado pela fórmula:
ΔT = Q / (m * c)
Como ambos os líquidos absorvem a mesma quantidade de calor, Q, a variação de temperatura de cada líquido será inversamente proporcional à sua massa e ao seu calor específico.
Portanto, podemos concluir que:
(mA * cA) / (mB * cB) = ΔT_A / ΔT_B
O gráfico fornecido mostra que, para a mesma quantidade de calor absorvido, a variação de temperatura do líquido A é 1/3 da variação de temperatura do líquido B. Isso significa que:
(mA * cA) / (mB * cB) = 1/3
Logo, a alternativa correta é A) 1/3.
Questão 1136
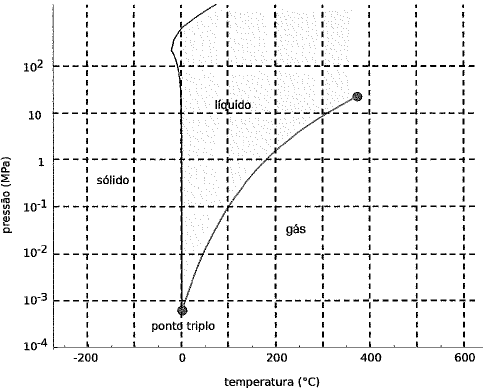
Uma máquina de café expresso possui duas pequenas caldeiras mantidas sob uma pressão de 1,OMPa. Duas resistências elétricas aquecem separadamente a água no interior das caldeiras até as temperaturas TA ºC, na caldeira com água para o café, e TBºC, na caldeira destinada a produzir vapor d’água para aquecer leite. Assuma que a temperatura do café na xícara, TCºC, não deve ultrapassar o ponto de ebulição da água e que não há perdas térmicas, ou seja, TC=TA. Considerando o diagrama de fases no gráfico acima, quanto vale, aproximadamente, o menor valor, em kelvins, da diferença TB-TA?
Dado: 1,0 atm = 0, 1MPa
- A) 180
- B) 130
- C) 80
- D) 30
- E) zero
A alternativa correta é letra C) 80
Pessoal, reparem que na pressão dada de 1 Mpa a temperatura de ebulição da água está próxima de 200.
Logo, vamos colocar ela como sendo aproximadamente
T_B = 180 , ºC
Agora, a questão fala que a temperatura A tem que ser igual a temperatura de ebulição da água na xícara que equivale a 100 ºC.
Logo,
T_B - T_A = 180 - 100 = 80 , ºC
Reparem que para termos de variação de temperatura, tanto faz estar em Kelvin ou Celsius, pois a variação será a mesma.
Gabarito: LETRA C.
1137) Com relação à dilatação dos sólidos e líquidos isotrópicos, analise as proposições a seguir e dê como resposta a soma dos números associados às afirmações corretas.
- A) 07
- B) 10
- C) 11
- D) 12
A alternativa correta é letra D) 12
Vamos analisar uma a uma pessoal,
(01) Um recipiente com dilatação desprezível contém certa massa de água na temperatura de 1°C , quando é, então, aquecido lentamente, sofrendo uma variação de temperatura de 6 °C . Nesse caso, o volume da água primeiro aumenta e depois diminui.
ERRADA. Pessoal, a variação é entre 0 e 4 graus que apresenta o fenômeno descrito. Entre essas faixas, ao aumentar a temperatura a água diminui seu volume, visto as pontes de hidrogênio começarem a ocupar um volume que antes estava vazio.
Acredito que a banca considerou esta como CORRETA visto a proximidade entre 4 e 6 graus. Entretanto, a grande maioria dos testes se referem a água em 4 graus.
(02) Quando se aquece uma placa metálica que apresenta um orifício, verifica-se que, com a dilatação da placa, a área do orifício aumenta.
ERRADA. Diminui pessoal, isso porque a barra vai aumentar (as extremidades do furo vão aproximar-se uma das outras).
(03) Quando um frasco completamente cheio de líquido é aquecido, este transborda um pouco. O volume de líquido transbordado mede a dilatação absoluta do líquido.
CORRETA. Realmente, podemos calcular esse volume da seguinte maneira.
Delta L = L_0 alpha Delta T
(04) O vidro pirex apresenta maior resistência ao choque térmico do que o vidro comum porque tem menor coeficiente de dilatação térmica do que o vidro comum.
CORRETA. Quanto menor o coeficiente de expansão, mais resistente é o material ao choque térmico.
(05) Sob pressão normal, quando uma massa de água é aquecida de 0 °C até 100 °C sua densidade sempre aumenta.
ERRADA. Conforme explicada na sentença 01, temos uma pequena faixa de comportamento anômalo que faz a densidade aumentar (volume diminuir). A partir de 4 graus, a densidade diminui com o aumento do volume.
(06) Ao se elevar a temperatura de um sistema constituído por três barras retas e idênticas de ferro interligadas de modo a formarem um triângulo isósceles, os ângulos internos desse triângulo não se alteram.
ERRADA. Caso tivéssemos um triângulo equilátero observaríamos tal fenômeno. Como temos um isósceles, uma das barras irá deformar de forma diferente das outras duas, o que vai acarretar em mudanças de ângulo.
Gabarito do Professor: LETRA A.
Gabarito da Banca: LETRA D.
1138) Em um recipiente termicamente isolado de capacidade térmica 40,0 cal / °C e na temperatura de 25 °C são colocados 600 g de gelo a −10 °C e uma garrafa parcialmente cheia, contendo 2,0 L de refrigerante também a 25 °C , sob pressão normal.
- A) −3,0
- B) 0,0
- C) 3,0
- D) 5,0
A alternativa correta é letra B) 0,0
Pessoal, vamos inicialmente ver o quanto de calor que os corpos mais quentes irão ceder e depois o quanto os corpos mais frios irão receber para chegar até 0 graus.
Para o refrigerante e o recipiente (mais quentes)
Q = m_R c_R Delta T_R + C_{Rec} Delta T_{Rec}
Q = 2.000 times 1 (0 - 25) + 40 times (0 -25) = - 51.000 , J
Agora, é a vez do gelo,
Q = m_g c_g delta T_g + m_g L_g
Q = 600 times 0,5 times (0 - (-10)) + 600 times 80 = + 51.000 , J
Pessoal, reparem que "não sobrou energia" para nenhuma transformação além da conversão de gelo para água. Logo, teremos água líquida e refrigerante líquido a zero graus (que foi a temperatura que definimos).
Gabarito: LETRA B.
1139) Com o objetivo de descobrir o calor específico de uma liga metálica, colocou-se 0,5kg da liga dentro de um pequeno forno elétrico no qual podia ser lida a seguinte especificação: 120V-10A. Considerando que o forno funcionou plenamente de acordo com as especificações e que, após 1 minuto, a temperatura da liga sofreu uma variação de 80K, pode-se afirmar que o valor encontrado para o calor específico foi, em cal/gºC, de
- A) 0,25
- B) 0,30
- C) 0,35
- D) 0,40
- E) 0,45
A alternativa correta é letra E) 0,45
ALTERNATIVA CORRETA: LETRA E
Dados da questão
m-0,5kg=500g
Especificações: 120V-10A.
Delta t = 1min=60s
Delta T = 80K = 80°C, Obs.: A variação de temperatura na escala Kelvin é a mesma para a escala Celsius.
1 cal=4J
o calor específico foi, em cal/gºC, de
Cálculo da potência do forno usando as especificações fornecidas:
P = U.i = 120.10=1200W
Equações da potência e do calor sensível:
P = frac{Q}{Delta t}, Logo, Q = P.Delta t
Q=1200.60=72000J=18000cal
Q=m.C_p.Delta T
Fazendo as substituições para determinar o calor específico:
Q=m.C_p.Delta T
18000=500.C_P.80
C_p=frac{18000}{40000}=0,45cal/g.°C
ALTERNATIVA CORRETA: LETRA E
1140) Com relação aos conceitos e às leis da Termodinâmica, assinale V para a afirmativa verdadeira e F para a falsa.
- A) V, V e F.
- B) F, V e F.
- C) F, V e V.
- D) V, V e V.
- E) F, F e F.
Let's break down the correct answer, alternative B) F, V, and F.
The first statement "( ) Todo processo em que um gás parte de um estado de equilíbrio termodinâmico e a ele retorna, necessariamente, reversível." is FALSE. This is because not all processes that start and end in a state of thermodynamic equilibrium are reversible. Reversibility is a characteristic of idealized processes, and in reality, most processes are irreversible.
The second statement "( ) A variação da entropia de um gás que evolui de um estado de equilíbrio termodinâmico para outro, é a mesma, quer o processo tenha sido reversível ou irreversível." is TRUE. The entropy change of a system is a state function, meaning it only depends on the initial and final states of the system, not on the path taken to get from one state to another. Therefore, the entropy change is the same regardless of whether the process is reversible or irreversible.
The third statement "( ) A 2ª Lei da Termodinâmica afirma que a energia do Universo é constante." is FALSE. The second law of thermodynamics states that the total entropy of an isolated system always increases over time, except in reversible processes. It does not say that the energy of the universe is constant.
Therefore, the correct answer is alternative B) F, V, and F.
Note that the second law of thermodynamics is a fundamental principle that describes the direction of spontaneous processes and the concept of entropy. It is essential to understand the differences between reversible and irreversible processes and how they affect the entropy change of a system.
