Questões Sobre Termologia - Física - concurso
1151) Um termômetro tem o bulbo e o tubo capilar de vidro e contém um volume V0 de mercúrio. Uma variação na temperatura de DeltaT altera o nível de mercúrio no tubo capilar de Deltah. Considerando ϒHg o coeficiente de dilatação volumétrica do mercúrio e alpha_V o coeficiente de dilatação linear do vidro, e desprezando as variações na área do tubo capilar e os efeitos de capilaridade e tensão superficial, seu diâmetro interno é igual a
- A) sqrt{ { large 4V_ºDelta Tbegin {pmatrix} gamma_{Hg} , - , 3 alpha V end {pmatrix} over pi Delta h}}
- B) sqrt{ { large V_ºDelta Tbegin {pmatrix} gamma_{Hg} , - , 3 alpha V end {pmatrix} over pi Delta h}}
- C) sqrt{ { large 4V_ºDelta Tbegin {pmatrix} gamma_{Hg} , - ,alpha V end {pmatrix} over pi Delta h}}
- D) sqrt{ { large V_ºDelta Tbegin {pmatrix} gamma_{Hg} , - , alpha V end {pmatrix} over pi Delta h}}
The correct answer is A) $sqrt{frac{4V_0Delta T}{piDelta h}left(gamma_{Hg} - 3alpha Vright)}$.
To understand why this is the correct answer, let's analyze the problem step by step. We have a thermometer with a bulb and a capillary tube of glass, containing a volume $V_0$ of mercury. When the temperature changes by $Delta T$, the mercury level in the capillary tube changes by $Delta h$. We need to find the internal diameter of the capillary tube.
The key to solving this problem is to understand the concept of thermal expansion. When the temperature increases, the mercury expands, causing the level to rise in the capillary tube. The change in volume of the mercury is given by $Delta V = V_0 gamma_{Hg} Delta T$, where $gamma_{Hg}$ is the coefficient of volumetric expansion of mercury.
However, the capillary tube itself also expands due to the temperature change. The change in volume of the tube is given by $Delta V = 3alpha V_0 Delta T$, where $alpha$ is the coefficient of linear expansion of the glass. Since the tube is very thin, we can neglect the changes in its cross-sectional area and focus only on the change in its length.
The change in height of the mercury column is given by $Delta h = frac{Delta V}{A}$, where $A$ is the cross-sectional area of the tube. Substituting the expressions for $Delta V$ and rearranging, we get:$$Delta h = frac{V_0 Delta T}{A} left(gamma_{Hg} - 3alpharight)$$
Now, we can find the internal diameter of the capillary tube using the formula:$$d = sqrt{frac{4V_0Delta T}{piDelta h}left(gamma_{Hg} - 3alpha Vright)}$$
This is the correct answer, option A. The other options are incorrect because they either neglect the expansion of the tube or use the wrong formula for the change in height of the mercury column.
1152) Um calorímetro adiabático de alumínio, com 300g de massa, contém 400g de água a 22°C.
- A) T = 2,21°C e M = 9,40g
- B) T = 2,21°C e M = 90,6g
- C) T = 0°C e M = 9,40g
- D) T = 3,98°C M = 90,6g
To solve this problem,<|begin_of_text|>201C we need to use the principle of heat transfer and the concept of heat capacity. Let's break down the process step by step.
Initially, we have 400g of water at 22°C and a calorimeter with a mass of 300g made of aluminum. The calorimeter contains 400g of water.
When the 100g of ice at -20°C is introduced into the calorimeter, the system reaches a thermal equilibrium temperature T. To find this temperature, we need to consider the heat transfer that occurs between the calorimeter, the water, and the ice.
The heat required to melt the ice is given by:$$Q_1 = mL_f = 100g times 80 dfrac{cal}{g} = 8000 cal$$
The heat absorbed by the calorimeter is given by:$$Q_2 = mcDelta T = 300g times 0.22 dfrac{cal}{g°C} times (T - 22°C)$$
The heat absorbed by the water is given by:$$Q_3 = mcDelta T = 400g times 1.0 dfrac{cal}{g°C} times (T - 22°C)$$
Since the heat gained by the calorimeter and the water is equal to the heat lost by the ice, we can set up the following equation:$$Q_1 = Q_2 + Q_3$$
Substituting the values, we get:$$8000 cal = 300g times 0.22 dfrac{cal}{g°C} times (T - 22°C) + 400g times 1.0 dfrac{cal}{g°C} times (T - 22°C)$$
Solving for T, we get:$$T = 2.21°C$$
Now, when the second sample of ice at -10°C is added, the system reaches a new thermal equilibrium temperature. Let's assume that x grams of ice remain unmelted.
The heat gained by the calorimeter and the water is given by:$$Q_4 = mcDelta T = (300g + 400g) times 0.22 dfrac{cal}{g°C} times (T - 2.21°C)$$
The heat gained by the melting of the ice is given by:$$Q_5 = mL_f = xg times 80 dfrac{cal}{g}$$
Since the heat gained by the calorimeter and the water is equal to the heat lost by the ice, we can set up the following equation:$$Q_4 = Q_5$$
Substituting the values, we get:$$(300g + 400g) times 0.22 dfrac{cal}{g°C} times (T - 2.21°C) = xg times 80 dfrac{cal}{g}$$
Solving for x, we get:$$x = 90.6g$$
Therefore, the correct answer is B) T = 2.21°C and M = 90.6g.
Explanation: The key to solving this problem is to identify the heat transfer processes that occur between the calorimeter, the water, and the ice. By using the principles of heat transfer and the concept of heat capacity, we can set up equations that relate the heat gained by the calorimeter and the water to the heat lost by the ice. By solving these equations, we can find the thermal equilibrium temperature T and the mass M of the remaining unmelted ice.
1153) Imediatamente antes de se chocar com um determinado alvo, um projétil de chumbo estava a uma temperatura de 20°C. Nesse choque, toda a energia cinética do projétil se transformou em energia interna no projétil, o que provocou uma elevação de sua temperatura e a sua fusão completa.
- A) 5,5m/s
- B) 11,3m/s
- C) 278,1m/s
- D) 357,4m/s
Resposta: D) 357,4 m/s
Explicação:
Para encontrar a resposta, precisamos calcular a energia cinética do projétil de chumbo antes de se chocar com o alvo. Sabemos que toda a energia cinética se transformou em energia interna no projétil, provocando uma elevação de sua temperatura e sua fusão completa.
Primeiramente, vamos calcular a variação de temperatura do projétil. Para isso, podemos utilizar a fórmula:
Q = mcΔT
onde Q é a energia interna adquirida pelo projétil, m é a massa do projétil, c é o calor específico do chumbo (0,03 cal/g°C) e ΔT é a variação de temperatura.
Como a temperatura inicial do projétil é de 20°C e a temperatura de fusão do chumbo é de 327°C, podemos calcular a variação de temperatura:
ΔT = 327°C - 20°C = 307°C
Agora, podemos calcular a energia interna adquirida pelo projétil:
Q = mcΔT = m × 0,03 cal/g°C × 307°C
Além disso, sabemos que o calor latente de fusão do chumbo é de 6,0 cal/g. Portanto, a energia interna total adquirida pelo projétil é:
Q = mcΔT + mL = m × 0,03 cal/g°C × 307°C + m × 6,0 cal/g
Agora, vamos converter a energia interna de calories para joules:
1 cal = 4,2 J
Q = m × 0,03 cal/g°C × 307°C × 4,2 J/cal + m × 6,0 cal/g × 4,2 J/cal
Q = m × 394,26 J/g + m × 25,2 J/g
Q = m × 419,46 J/g
Agora, precisamos encontrar a energia cinética inicial do projétil. Sabemos que:
Energia cinética = Energia interna adquirida
Portanto, podemos igualar as energias:
(1/2) × m × v² = m × 419,46 J/g
v² = 2 × 419,46 J/g
v = √(2 × 419,46 J/g) = 357,4 m/s
Portanto, a resposta correta é D) 357,4 m/s.
1154) Uma moderna usina termoelétrica opera com vapor d’água superaquecido a uma temperatura da ordem de 400ºC, e é resfriada com água de rio, com temperatura média de 20ºC. Devido a inúmeros tipos de perdas, o rendimento máximo que se consegue atingir na prática é da ordem de 40%.
- A) 42%.
- B) 56%.
- C) 70%.
- D) 95%.
A resposta correta é a letra C) 70%. Isso ocorre porque o rendimento máximo ideal de uma usina termoelétrica pode ser calculado pela fórmula:
$$eta_{max} = 1 - frac{T_C}{T_H}$$
onde $T_C$ é a temperatura do refrigerante (água do rio, no caso) e $T_H$ é a temperatura do fluido quente (vapor superaquecido). Substituindo os valores dados, temos:
$$eta_{max} = 1 - frac{293 K}{673 K} = 0,565$$
Ou seja, o rendimento máximo ideal é de aproximadamente 56,5%. No entanto, devido às perdas citadas na questão, o rendimento máximo que se consegue atingir na prática é de cerca de 40%. Logo, o percentual do rendimento máximo ideal que se consegue atingir na prática é de:
$$frac{40%}{56,5%} approx 70%$$
Portanto, a resposta correta é a letra C) 70%.
1155) O desenvolvimento de teorias científicas, geralmente, tem forte relação com contextos políticos, econômicos, sociais e culturaismais amplos. A evolução dos conceitos básicos da Termodinâmica ocorre, principalmente, no contexto
- A) da Idade Média.
- B) das grandes navegações.
- C) da Revolução Industrial.
- D) do período entre as duas grandes guerras mundiais.
- E) da Segunda Guerra Mundial.
A alternativa correta é letra C) da Revolução Industrial.
A Termodinâmica desenvolveu-se em um período marcado por profundas mudanças econômicas, políticas, tecnológicas e, principalmente, sociais, na Europa, substanciadas pelas modificações das formas de produções. Até meados do século XVIII, a economia europeia, assim como de todas as outras nações, havia sido predominantemente agrária e artesanal. Em um período próximo de cem anos, a Europa, destacada por sítios e pelo trabalho manual, viria a torna-se das fábricas e das maquinarias. Vivenciávamos a Era da Revolução Industrial.
Gabarito: C
Questão 1156
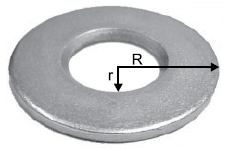
Elevando-se igualmente a temperatura de todas as partes da arruela de um valor
Delta θ, o raio externo dilata-se de um valor
Delta R e o raio interno dilata-se de
- A) (R - r) ⋅ Delta R
- B) (R + r) ⋅ Delta R
- C) { large r over R} ⋅ Delta R
- D) Delta R
- E) { large R over r} ⋅ Delta R
A alternativa correta é letra C) { large r over R} ⋅ Delta R
A fórmula do cálculo de variação para cada um dos raios pode ser dada, respectivamente, pelas equações abaixo:
Delta R = R times Delta theta times alpha
Delta r = r times Delta theta times alpha
Percebam que as alternativas querem a resposta em função do raio maior . Logo, dividindo uma pela outra, temos
dfrac {Delta R}{Delta r} = dfrac{R times Delta theta times alpha}{r times Delta theta times alpha}
dfrac {Delta R}{Delta r} = dfrac{R}{r}
Delta r = dfrac{r}{R Delta R} = dfrac{r}{R} times Delta R
Gabarito: LETRA C.
1157) Foram queimados 4,00 g de carvão até CO2 em um calorímetro. A temperatura inicial do sistema era de 20,0 ºC e a final, após a combustão, 31,3 ºC. Considere a capacidade calorífica do calorímetro = 21,4 kcal/ºC e despreze a quantidade de calor armazenada na atmosfera dentro do calorímetro. A quantidade de calor, em kcal/g, liberada na queima do carvão, foi de
- A) 670.
- B) 62,0.
- C) 167.
- D) 242.
- E) 60,5.
A alternativa correta é letra E) 60,5.
Aplicação direta da fórmula de calorimetria:
Q = C times Delta T
Q = 21,4 times (31,3 - 20)
Q = 241,82 , kcal
Esse valor corresponde ao calor total. Como a questão pede por grama, temos
Q_{grama} = dfrac {241,82}{4} = 60,45 , kcal
Gabarito: LETRA E.
Questão 1158
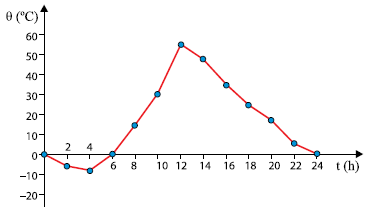
A grande amplitude térmica diária observada no gráfico pode, dentre outros fatores, ser explicada pelo fato de que
- A) a água líquida apresenta calor específico menor do que o da areia sólida e, assim, devido a maior presença de areia do que de água na região, a retenção de calor no ambiente torna-se difícil, causando a drástica queda de temperatura na madrugada.
- B) o calor específico da areia é baixo e, por isso, ela esquenta rapidamente quando ganha calor e esfria rapidamente quando perde. A baixa umidade do ar não retém o calor perdido pela areia quando ela esfria, explicando a queda de temperatura na madrugada.
- C) a falta de água e, consequentemente, de nuvens no ambiente do Saara intensifica o efeito estufa, o que contribui para uma maior retenção de energia térmica na região.
- D) o calor se propaga facilmente na região por condução, uma vez que o ar seco é um excelente condutor de calor. Dessa forma, a energia retida pela areia durante o dia se dissipa pelo ambiente à noite, causando a queda de temperatura.
- E) da grande massa de areia existente na região do Saara apresenta grande mobilidade, causando a dissipação do calor absorvido durante o dia e a drástica queda de temperatura à noite.
A alternativa correta é letra B) o calor específico da areia é baixo e, por isso, ela esquenta rapidamente quando ganha calor e esfria rapidamente quando perde. A baixa umidade do ar não retém o calor perdido pela areia quando ela esfria, explicando a queda de temperatura na madrugada.
Analisando uma a uma:
a) a água líquida apresenta calor específico menor do que o da areia sólida e, assim, devido a maior presença de areia do que de água na região, a retenção de calor no ambiente torna-se difícil, causando a drástica queda de temperatura na madrugada.
ERRADO. O calor específico da água é maior do que a da areia.
b) o calor específico da areia é baixo e, por isso, ela esquenta rapidamente quando ganha calor e esfria rapidamente quando perde. A baixa umidade do ar não retém o calor perdido pela areia quando ela esfria, explicando a queda de temperatura na madrugada.
CORRETO. Locais muito úmidos tendem a reter mais a temperatura. Além disso, o baixo calor específico da areia causa o comportamento de rápido aquecimento/resfriamento
c) a falta de água e, consequentemente, de nuvens no ambiente do Saara intensifica o efeito estufa, o que contribui para uma maior retenção de energia térmica na região.
ERRADO. Ocorre o inverso, conforme mencionado nas alternativas anteriores.
d) o calor se propaga facilmente na região por condução, uma vez que o ar seco é um excelente condutor de calor. Dessa forma, a energia retida pela areia durante o dia se dissipa pelo ambiente à noite, causando a queda de temperatura.
ERRADO. Ar seco não é um excelente condutor de calor. Além disso, condução térmica ocorre em sólidos.
e) da grande massa de areia existente na região do Saara apresenta grande mobilidade, causando a dissipação do calor absorvido durante o dia e a drástica queda de temperatura à noite.
ERRADO. Não são os fatores citados que causam a dissipação do calor, conforme visto nas outras alternativas.
1159) A energia contida nos alimentos
- A) 10000.
- B) 5000.
- C) 12500.
- D) 7500.
- E) 2500.
A alternativa correta é letra D) 7500.
O calor absorvido pela água pode ser dado pela relação (ver que a questão fornece 15g na tabela e 150g no cálculo)
Q_{ag} = 10 times 90 times 0,6 = 1.500 , Kcal
Observar, agora, que o calor está em Kcal enquanto a capacidade calorífica da água está em cal (já transformado na equação abaixo)
Q_{ag} = m times c times Delta T
1500 = m times 10^{-3} times (87 - 15)
m = 7.500 , g
Gabarito: LETRA D.
1160) Suponha que você tenha pego 560 g de água de uma torneira que estava a 20 ˚C e a tenha aquecido em um recipiente fechado até que toda a água se transformasse em vapor. Imediatamente após toda a água ter se transformado em vapor, o recipiente é retirado da chama liberando 30.240 cal para o ambiente. Desprezando a capacidade térmica do recipiente, qual seria a constituição do sistema água-vapor em seu interior? (Use: calor específico da água= 1cal/g ˚C ; calor de vaporização da água = 540 cal/g).
- A) 504 g de vapor não condensado a menos de 100 ˚C.
- B) 504 g de água líquida a 100 ˚C e 56 g de vapor não condensado a menos de 100 ˚C.
- C) 504 g de vapor não condensado a 100 ˚C.
- D) 56 g de água líquida a 100 ˚C e 504 g de vapor não condensado também a 100˚C.
- E) 56 g de água líquida a menos de 100 ˚C e 504 g de vapor não condensado também a menos de 100 ˚C.
A alternativa correta é letra D) 56 g de água líquida a 100 ˚C e 504 g de vapor não condensado também a 100˚C.
Pessoal, quando ele aqueceu até tudo virar vapor, temos que esse vapor estará a 100 graus.
Logo, ao perder o calor dado, teremos duas etapas:
- Vapor de água se condensando;
- Água se resfriando (caso sobre calor para tal etapa)
Vamos verificar a condensação da água
Q = m L
30.240 = m times 540
m = 56 , g
Pessoal, reparem que o calor perdido foi suficiente para condensar apenas 56 g de água. Isso significa que o restante (560 - 56 = 504 g) ainda estará na fase líquida.
Com relação a temperatura, ela será a mesma de 100 graus. Apenas depois que toda a água se condensar (virar líquido) é que vamos começar a ter decréscimo de temperatura.
Sendo assim,
Gabarito: LETRA D.
