Questões Sobre Termologia - Física - concurso
1181) Um caminhão tanque foi abastecido com 2 m3 de gasolina num dia em que a temperatura era de 30 0C. Ao chegar ao seu destino, a temperatura era de 15 0C. Sabendo-se que o coeficiente de expansão de volume da gasolina é 950 x 10 6 0C-1, podemos afirmar que, em virtude da diferença de temperatura:
- A) A diminuição de volume da gasolina foi de, aproximadamente, 28,5 litros.
- B) A diminuição de volume da gasolina foi de, aproximadamente, 28,5 cm3.
- C) A diminuição de volume da gasolina foi de, aproximadamente, 0,285 m3.
- D) O aumento de volume da gasolina foi de, aproximadamente, 28,5 litros.
- E) O aumento de volume da gasolina foi de, aproximadamente, 28,5 cm3.
A alternativa correta é letra A) A diminuição de volume da gasolina foi de, aproximadamente, 28,5 litros.
Gabarito: LETRA A.
Sendo V_0, gamma e Delta theta o volume inicial, o coeficiente de expansão volumétrica e a variação de temperatura de um corpo, o módulo da variação volumétrica é dado por:
Delta V = V_0 cdot gamma cdot Delta theta
Logo,
Delta V = 2,0 cdot 950 times 10^{-6} cdot left( 30 - 15 right)
Delta V = 0,0285 , m^3
Como 1 , m^3 = 1000 , l, temos que:
Delta V = 28,5 ,l
Como houve uma diminuição de temperatura, houve também uma diminuição de volume.
Portanto, a resposta correta é a alternativa (a).
1182) Os casos a seguir são bons exemplos de transmissão de calor por radiação, exceto:
- A) Um forno micro ondas esquentando um copo de leite.
- B) Uma lareira queimando lenha para esquentar uma sala.
- C) Uma porta aberta para esfriar uma sala.
- D) O Sol aquecendo a Terra.
- E) Uma lâmpada sendo utilizada em bronzeamento artificial.
A alternativa correta é letra C) Uma porta aberta para esfriar uma sala.
Gabarito: LETRA C.
A transferência de calor pode ocorrer de três formas: condução, convecção e radiação.
A condução térmica é uma forma de transferência de energia térmica que ocorre entre átomos e moléculas vizinhas, de forma que as moléculas em agitação maior (temperatura mais alta) provocam uma maior agitação nas moléculas de temperatura mais baixa.
Já a convecção é um fenômeno de transferência de calor que consiste na transferência de energia térmica através do movimento de um fluido (como o ar), devido à diferença de temperatura. A alternativa que traz um exemplo de transmissão de calor por convecção é a letra (c) Uma porta aberta para esfriar uma sala.
Por fim, a irradiação é uma forma de transferência de energia térmica que ocorre por meio de ondas eletromagnéticas, que está exemplificada em todas as alternativas, exceto a alternativa (c).
Portanto, a resposta correta é a alternativa (c).
1183) A partir da seguinte tabela, é possível classificar as substâncias quanto à quantidade de calor necessária para elevar a temperatura das mesmas em 1 oC.
- A) 1 kg Álcool Etílico; 1 kg de Mercúrio; 1 Mol de Álcool Etílico e 1 Mol de Mercúrio.
- B) 1 kg de Mercúrio; 1 kg Álcool Etílico; 1 Mol de Álcool Etílico e 1 Mol de Mercúrio.
- C) 1 Mol de Álcool Etílico; 1 Mol de Mercúrio; 1 kg Álcool Etílico e 1 kg de Mercúrio.
- D) 1 kg de Mercúrio; 1 Mol de Álcool Etílico; 1 Mol de Mercúrio e 1 kg Álcool Etílico.
- E) 1 kg de Álcool Etílico; 1 Mol de Álcool Etílico; 1 kg de Mercúrio e 1 Mol de Mercúrio.
A alternativa correta é letra A) 1 kg Álcool Etílico; 1 kg de Mercúrio; 1 Mol de Álcool Etílico e 1 Mol de Mercúrio.
Gabarito: LETRA A.
Sabemos que o calor específico é a quantidade de energia necessária para elevar a temperatura de uma determinada massa de uma substância, e que é dado pela equação a seguir:
Q = m c Delta theta
Utilizando as unidades da tabela, e sabendo que a variação de 1°C é igual a de 1 K, podemos calcular a quantidade de calor necessária para elevar a temperatura das quantidades das alternativas em 1 °C da seguinte maneira:
- 1 kg de Álcool Etílico:
Q_{1 , kg , Álcool , Etílico} = m_{Álcool , Etílico} cdot c_{Álcool , Etílico} cdot Delta theta
Q_{1 , kg , Álcool , Etílico} = 1,0 cancel {kg} cdot dfrac { 2428 , J } { cancel {kg} cancel {°C} } cdot 1 cancel {°C}
Q_{1 , kg , Álcool , Etílico} = 2428 , J
- 1 kg de Mercúrio:
Q_{1 , kg , Mercúrio} = m_{Mercúrio} cdot c_{Mercúrio} cdot Delta theta
Q_{1 , kg , Mercúrio} = 1,0 cancel {kg} cdot dfrac { 138 , J } { cancel {kg} cancel {°C} } cdot 1 cancel {°C}
Q_{1 , kg , Mercúrio} = 138 , J
- 1 Mol de Álcool Etílico:
Q_{1 , Mol , Álcool , Etílico} = n_{Álcool , Etílico} cdot MM_{Álcool , Etílico} cdot c_{Álcool , Etílico} cdot Delta theta
Q_{1 , Mol , Álcool , Etílico} = 1,0 cancel {Mol} cdot dfrac { 0,0461 cancel {kg} } { cancel {Mol} }cdot dfrac { 2428 , J } { cancel {kg} cancel {°C} } cdot 1 cancel {°C}
Q_{1 , Mol , Álcool , Etílico} approx 111,9 , J
- 1 Mol de Mercúrio:
Q_{1 , Mol , Mercúrio} = n_{Mercúrio} cdot MM_{Mercúrio} cdot c_{Mercúrio} cdot Delta theta
Q_{1 , Mol , Mercúrio} = 1,0 cancel {Mol} cdot dfrac { 0,201 cancel {kg} } { cancel {Mol} }cdot dfrac { 138 , J } { cancel {kg} cancel {°C} } cdot 1 cancel {°C}
Q_{1 , Mol , Mercúrio} approx 27,7 , J
Então, a ordem, do maior valor para o menor valor, será:
Q_{1 , kg , Álcool , Etílico} gt Q_{1 , kg , Mercúrio} gt Q_{1 , Mol , Álcool , Etílico} gt Q_{1 , Mol , Mercúrio}
Portanto, a resposta correta é a alternativa (a).
1184) Assinale a alternativa correta. A água sempre entra em fervura quando:
- A) A temperatura atinge 100 oC.
- B) A pressão de saturação do vapor é igual à pressão atmosférica.
- C) A pressão de vapor é de 1 g/cm2.
- D) A pressão atmosférica é de 2 atm.
- E) A temperatura do gás é suficiente para ele não se liquefazer.
A alternativa correta é letra B) A pressão de saturação do vapor é igual à pressão atmosférica.
Gabarito: LETRA B.
Sabemos que as moléculas de um líquido em uma panela com água estão sempre em movimento, de forma que, ao atingir as paredes da panela, uma força é aplicada sobre uma área, ou seja, existe uma pressão que é chamada de pressão de vapor.
Da mesma forma, as moléculas também atingem a superfície, encontrando duas barreiras: a tensão superficial e a pressão atmosférica. Ao romper essa barreira, a molécula passa do estado líquido para o gasoso, e vice-versa.
Durante a evaporação, mais moléculas passam do estado líquido para o gasoso do que ao contrário. Por outro lado, quando mais moléculas passam do estado gasoso para o líquido, ocorre a condensação.
Quando há um equilíbrio dinâmico, no qual as moléculas do líquido passam com a mesma taxa de um estado para o outro, a pressão de vapor nesse estado é chamada de pressão de vapor de saturação.
Quando aumentamos a temperatura da água, a pressão de vapor aumenta até se igualar à pressão atmosférica. Nesse instante, o líquido entra em ebulição, pois a energia cinética das moléculas aumenta e elas poderão escapar da superfície de água como vapor mais facilmente.
Assim, podemos afirmar que a água sempre entra em fervura quando a pressão de saturação do vapor é igual à pressão atmosférica.
A água nem sempre ferve quando sua temperatura atinge 100°C. Para tanto, a pressão atmosférica deve ser de 1 atm.
Portanto, a resposta correta é a alternativa (b).
1185) Assinale a alternativa correta que indica quantas calorias são requeridas para aquecer 400 g de água de 23 oC para 33 oC.
- A) 40.
- B) 400.
- C) 0,4.
- D) 4000.
- E) 9200.
A alternativa correta é letra D) 4000.
Gabarito: LETRA D.
A quantidade de calor necessária para uma massa m de uma substância de calor específico c aumentar sua temperatura em Delta theta é dada por:
Q = m c Delta theta
Como o calor específico da água é 1cal/g°C, temos que:
Q = 400 cdot 1 cdot left( 33 - 23 right)
Q = 4000 , cal
Portanto, a resposta correta é a alternativa (d).
1186) Sobre a grandeza temperatura, não é correto afirmar que:
- A) É uma grandeza diretamente relacionada à lei zero da Termodinâmica.
- B) É uma grandeza escalar.
- C) É a mesma em dois corpos em equilíbrio térmico.
- D) Sempre aumenta ao se fornecer calor a um corpo.
- E) É uma função de estado.
A alternativa correta é a letra D) Sempre aumenta ao se fornecer calor a um corpo.
Explicação: A temperatura é uma grandeza que não aumenta sempre que se fornece calor a um corpo. Isso ocorre porque a temperatura é uma medida do nível de agitação térmica das partículas de uma substância, e não é diretamente proporcional à quantidade de calor adicionada.
Quando um corpo recebe calor, as moléculas começam a se mover mais rapidamente, aumentando a energia cinética delas. No entanto, a temperatura do corpo não aumenta linearmente com a quantidade de calor adicionada. Em vez disso, a temperatura aumenta até que o corpo atinja o equilíbrio térmico, quando a energia cinética das moléculas se distribui uniformemente.
Além disso, a temperatura também depende de outros fatores, como a pressão e o volume do corpo. Portanto, não é correto afirmar que a temperatura sempre aumenta ao se fornecer calor a um corpo.
A lei zero da termodinâmica estabelece que se dois corpos estiverem em equilíbrio térmico, eles terão a mesma temperatura. Isso significa que a temperatura é uma propriedade que caracteriza o estado de equilíbrio térmico de um sistema, e não é diretamente relacionada à quantidade de calor adicionada.
Em resumo, a temperatura é uma grandeza que depende de vários fatores, incluindo a energia cinética das moléculas, a pressão e o volume do corpo. Portanto, não é correto afirmar que a temperatura sempre aumenta ao se fornecer calor a um corpo.
1187) A condutividade térmica e o coeficiente de dilatação térmica podem ser medidos em:
- A) J/(cm.s.K) e K/m respectivamente.
- B) N/s e m/K respectivamente.
- C) N/(s.K) e K-1 respectivamente.
- D) J/(cm.K) e K-1 respectivamente.
- E) J/K e m-1K-1 respectivamente
A resposta certa é a letra C) N/(s.K) e K-1 respectivamente.
Essa questão está relacionada à termologia, que é o estudo das propriedades térmicas dos materiais. A condutividade térmica e o coeficiente de dilatação térmica são duas propriedades importantes que podem ser medidas em diferentes unidades.
A condutividade térmica é a capacidade de um material de conduzir calor. É medida em unidades de J/(cm.s.K), que representa a quantidade de calor que pode ser conduzida por unidade de área, tempo e gradiente de temperatura.
O coeficiente de dilatação térmica, por outro lado, é a variação da dimensão de um material em resposta à variação de temperatura. É medida em unidades de K-1, que representa a variação da dimensão por unidade de temperatura.
As alternativas A) J/(cm.s.K) e K/m, B) N/s e m/K, D) J/(cm.K) e K-1 e E) J/K e m-1K-1 estão todas erradas porque não representam as unidades corretas para a condutividade térmica e o coeficiente de dilatação térmica.
A alternativa C) N/(s.K) e K-1 é a resposta certa porque N/(s.K) é uma unidade possível para a condutividade térmica (embora não seja a mais comum) e K-1 é a unidade correta para o coeficiente de dilatação térmica.
É importante notar que as unidades devem ser consistentes com as definições das grandezas físicas e não podem ser escolhidas arbitrariamente.
Questão 1188
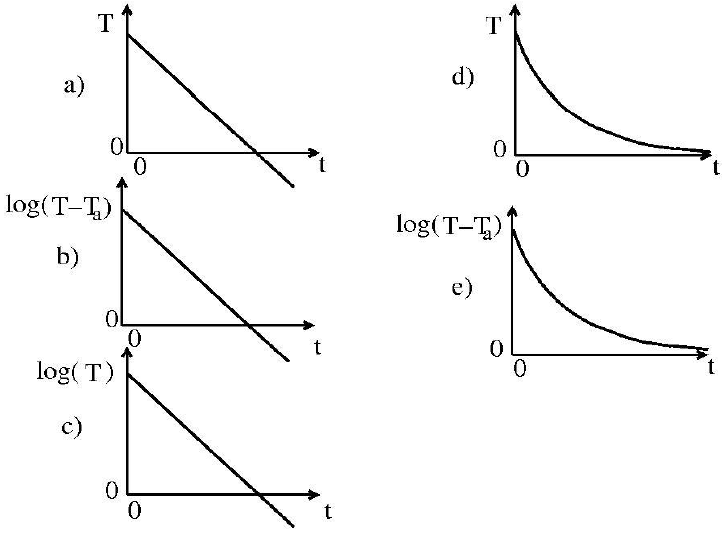
- A) Gráfico a.
- B) Gráfico b.
- C) Gráfico c.
- D) Gráfico d.
- E) Gráfico e.
A alternativa correta é a letra B) Gráfico b.
O gráfico que melhor representa a evolução temporal da temperatura de uma xícara de água quente deixada esfriando sobre a mesa da cozinha a uma temperatura ambiente Ta é o gráfico b. Isso ocorre porque, inicialmente, a temperatura da água é muito maior que a temperatura ambiente, então a água perde calor rapidamente para o ambiente, o que é representado pela curva decrescente do gráfico. À medida que a temperatura da água se aproxima da temperatura ambiente, a perda de calor se torna menos intensa, o que é representado pela curva que se aproxima de um platô.
Os gráficos a, c, d e e não representam a evolução temporal da temperatura da água de forma correta. O gráfico a apresenta uma curva crescente, o que não faz sentido, pois a temperatura da água não aumenta com o tempo. O gráfico c apresenta uma curva constante, o que não é verdadeiro, pois a temperatura da água muda com o tempo. O gráfico d apresenta uma curva quecai abruptamente e, em seguida, se estabiliza, o que não é uma representação realista da perda de calor. O gráfico e apresenta uma curva que cresce e, em seguida, decresce, o que não faz sentido no contexto da perda de calor.
Portanto, o gráfico b é o que melhor representa a evolução temporal da temperatura da água quente deixada esfriando sobre a mesa da cozinha a uma temperatura ambiente Ta.
1189) Um calorímetro de capacidade térmica 40 cal/ºC possui em seu interior e em equilíbrio térmico, 400g de água a 10ºC. Em um dado instante, um corpo metálico de 300g e temperatura de 60ºC é colocado no interior do calorímetro e o sistema agitado até a obter a situação de equilíbrio térmico. A temperatura final de equilíbrio é de 16ºC. O calor específico da água é 1 cal/gºC.
- A) 0,2.
- B) 0,1.
- C) 0,5.
- D) 0,4.
Para resolver essa questão, vamos utilizar a fórmula de troca de calor entre dois corpos em contato. Nesse caso, temos o calorímetro com 400g de água a 10°C e o corpo metálico de 300g a 60°C. Após o equilíbrio térmico, a temperatura final é de 16°C.
Vamos considerar que o calorímetro é ideal, ou seja, não há perda de calor para o meio ambiente. Então, o calor específico da água é de 1 cal/g°C. Podemos calcular a variação de temperatura da água como:
ΔT = Tf - Ti = 16°C - 10°C = 6°C
O calor transferido da água é:
Qágua = mágua × cágua × ΔT = 400g × 1 cal/g°C × 6°C = 2400 cal
O calor transferido pelo corpo metálico é igual em módulo, mas oposto em sentido:
Qmetálico = -Qágua = -2400 cal
Agora, vamos calcular a variação de temperatura do corpo metálico:
ΔT = Tf - Ti = 16°C - 60°C = -44°C
O calor específico do metal é desconhecido, então vamos chamá-lo de c. Podemos calcular o calor específico do metal como:
Qmetálico = mmetálico × c × ΔT
Substituindo os valores, temos:
-2400 cal = 300g × c × (-44°C)
Agora, podemos calcular o calor específico do metal:
c = 2400 cal / (300g × 44°C) = 0,2 cal/g°C
Portanto, a alternativa correta é A) 0,2.
A alternativa correta é A) 0,2.
1190) Deseja-se produzir a mesma variação de temperatura, sem mudança de estado físico, em quatro amostras de diferentes gases com mesma temperatura inicial: Neônio (Ne); Hidrogênio (H2); Nitrogênio (N2); e Metano (CH4). Sabe-se que as quatro amostras possuem o mesmo número de mols e ocupam volumes fixos iguais.
- A) Hidrogênio (H2).
- B) Nitrogênio (N2)
- C) Metano (CH4).
- D) Neônio (Ne).
Resposta: D) Neônio (Ne)
A quantidade de energia trocada durante a variação de temperatura é menor para o neônio (Ne) porque ele tem a menor capacidade calorífica específica entre as quatro amostras.
Para que haja a mesma variação de temperatura em todas as amostras, é necessário que a quantidade de energia trocada seja proporcional à capacidade calorífica específica de cada gás. Quanto menor for a capacidade calorífica específica, menor será a quantidade de energia necessária para produzir a mesma variação de temperatura.
A capacidade calorífica específica é uma propriedade que depende da estrutura molecular do gás e da sua massa molar. Em geral, os gases nobres, como o neônio, têm capacidades caloríficas específicas menores em comparação com os gases diatômicos, como o hidrogênio e o nitrogênio, e com os compostos orgânicos, como o metano.
Portanto, para produzir a mesma variação de temperatura em todas as amostras, é necessário que a quantidade de energia trocada seja menor para o neônio, que tem a menor capacidade calorífica específica.
