Questões Sobre Termologia - Física - concurso
111) Sob pressão constante de 2 x 105Pa, certa quantidade de gás ideal se expande, passando do volume de 4 m3 para 7 m3. Sabendo que essa transformação é uma transformação Isobárica, quando a pressão é constante, o trabalho realizado por esse gás é em J de:
- A) 2 x 105.
- B) 4 x 105.
- C) 6 x 105.
- D) 3 x 105.
- E) Nenhuma das alternativas anteriores.
A alternativa correta é letra C) 6 x 105.
Quando ocorre uma transformação isobárica, o trabalho W realizado pelo gás é dado pela seguinte expressão:
W=PcdotDelta{V}
Onde Delta{V} é a variação no volume do gás. Então teremos:
W=2times10^{5}times(7 - 4)
W=2times10^{5}times(7 - 4)
boxed{W=6times10^{5},J}
Analisando as alternativas, concluímos que o gabarito é a letra C.
Gabarito: C
Questão 112
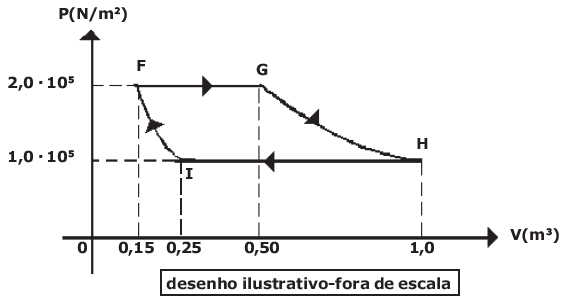
A variação de energia interna sofrida pelo gás na transformação adiabática IF é
- A) -40 kJ
- B) -20 kJ
- C) 15 kJ
- D) 25 kJ
- E) 30 kJ
A alternativa correta é letra C) 15 kJ
Pessoal, pelas informações dadas reparem que vamos ter que trabalhar com os dois processos isobáricos.
Delta U = Q - W
Começando por FG
Delta U_{FG} = 200.000 - 2 times 10^5 (0,5 - 0,15)
Delta U_{FG} = 130.000 , J
Agora em HI,
Delta U_{HI} = -220.000 - 10^5 (0,25 - 1,0)
Delta U_{HI} = -145.000 , J
Reparem então que teremos
Delta U_{FI} = 145.000 - 130.000 = 15.000 , J = 15 , kJ
Como ele quer a variação, precisamos colocar ambos em módulo 145.000 e 130.000. Aí, subtraímos um do outro.
Gabarito: LETRA C.
113) Um balão de vidro A, de 15,0 litros de volume, contém ar à temperatura de 25º C e sob pressão de 20,0 atm. Um outro balão B, de 20,0 litros de volume, contém ar à temperatura de 10º C e sob pressão de 5,0 atm. Os dois balões são postos em comunicação e a temperatura do conjunto é elevada a 40º C. Considerando-se o vidro como indilatável, e utilizando-se a constante universal dos gases perfeitos como R = 0,082 atm.L/mol.K, pode-se afirmar que a pressão do ar após a comunicação, é de
- A) 1,5 atm.
- B) 5,4 atm.
- C) 12,1 atm.
- D) 20,2 atm.
- E) 26,9 atm.
A alternativa correta é letra C) 12,1 atm.
Para uma mistura gasosa, podemos utilizar a relação:
dfrac{PV}{T} = dfrac{P_AV_A}{T_A}+dfrac{P_BV_B}{T_B}
Lembrando que as temperaturas devem ser utilizadas na escala Kelvin. Fazendo a conversão das temperaturas:
T_A = 25+273 = 298,K
T_A = 10+273 = 283,K
T = 40+273 = 313,K
Substituindo os valores de pressão volume e temperatura dos gases contidos nos balões A e B e sabendo que o volume da mistura dos gases (V) será a soma dos volumes dos dois balões (V_A+V_B = 35,L), pois a mistura gasosa estará ocupando os dois balões e não houve dilatação.
dfrac{PV}{T} = dfrac{P_AV_A}{T_A}+dfrac{P_BV_B}{T_B}
dfrac{Pcdot35}{313} = dfrac{20cdot 15}{298}+dfrac{5 cdot 20}{283}
dfrac{P cdot 35}{313} = dfrac{300}{298}+dfrac{100}{283}
Fazendo os cálculos com três algarismos significativos:
0,112P = 1,01 + 0,353
P = dfrac{1,36}{0,112}
P=12,1 , atm
Sendo assim, a pressão do ar após a comunicação dos dois balões é de 12,1 atm.
114) Um mergulhador precisa encher seu tanque de mergulho, cuja capacidade é de 1,42 × 10-2 m3, a uma pressão de 140 atm e sob temperatura constante.
- A) large{1 over 4}
- B) large{1 over 2}
- C) 2
- D) 4
A alternativa correta é letra C) 2
Gabarito: LETRA C.
De acordo com a lei geral dos gases ideais, podemos escrever:
dfrac { P_1 V_1 } { T_1 } = dfrac { P_2 V_2 } { T_2 }
Como a temperatura é mantida constante, temos
dfrac { P_1 V_1 } { cancel T } = dfrac { P_2 V_2 } { cancel T }
P_1 V_1 = P_2 V_2
Na situação 1, temos um volume V1 do gás a 1 atm. Na situação 2, temos 1,42 × 10-2 m3, a uma pressão de 140 atm. Então, a equação acima se torna:
1 cdot V_1 = 140 cdot 1,42 times 1^{-2}
V_1 = 1,988 , m^3
Portanto, a resposta correta é a alternativa (c).
115) Deseja-se resfriar um cilindro de armazenamento contendo 15 moles de gás comprimido de 40 °C para 10 °C. Considere o quadro a seguir dos calores específicos molares de gases a volume constante (cV) a baixas pressões.
- A) Um gás diatômico.
- B) Um gás poliatômico.
- C) Um gás monoatômico.
- D) Seria igualmente fácil com todos esses gases.
Para responder a essa questão, precisamos entender como os gases se comportam quando são resfriados. Em particular, precisamos considerar como o calor específico molar (cV) de cada gás varia com a temperatura.
Observando o quadro fornecido, podemos ver que os calores específicos molares dos gases são diferentes. Isso significa que, ao serem resfriados, os gases irão perder calor de maneira diferente.
Para responder à pergunta, precisamos determinar qual gás irá perder calor mais facilmente, ou seja, qual gás tem o menor calor específico molar. Ao analisar o quadro, podemos ver que o gás monoatômico (C) tem o menor calor específico molar.
Isso significa que, ao ser resfriado, o gás monoatômico irá perder calor mais facilmente do que os outros gases. Portanto, a resposta certa é a letra C) Um gás monoatômico.
Em resumo, o gás monoatômico é o que irá se resfriar mais facilmente porque tem o menor calor específico molar. Isso ocorre porque os gases monoatômicos têm uma estrutura molecular mais simples, o que os torna mais eficientes em perder calor.
Além disso, é importante notar que os gases diatômicos e poliatômicos têm estruturas moleculares mais complexas, o que os torna menos eficientes em perder calor. Portanto, eles irão se resfriar mais lentamente do que os gases monoatômicos.
116) Considere uma garrafa de refrigerante posta verticalmente sobre uma mesa horizontal. Com a garrafa ainda fechada, sua parte superior, entre a superfície do líquido e a tampa, é preenchida por um gás pressurizado. Considere que o refrigerante está inicialmente a 10 °C, e passados 10 minutos esteja a 21 °C. Sobre o gás entre a superfície do líquido e a tampa, é correto afirmar que, ao final dos 10 minutos,
- A) tem sua energia térmica aumentada e sua pressão reduzida.
- B) tem sua energia térmica e pressão aumentadas.
- C) tem sua energia térmica e sua pressão reduzidas.
- D) tem sua energia térmica reduzida e sua pressão aumentada.
A alternativa correta é letra B) tem sua energia térmica e pressão aumentadas.
Com o aumento da temperatura do gás, temos o aumento da sua energia interna (Energia interna é diretamente proporcional a temperatura).
A temperatura pode ser definida como o grau de agitação das moléculas que compõe o gás. Logo quanto maior temperatura, mais velocidade as moléculas possuem, e mais energia cinética.
A pressão por sua vez também aumenta com a temperatura, como podemos ver analiticamente abaixo
PV = nRT
Gabarito: LETRA B
117) Um gás ideal é mantido em um reservatório esférico de raio constante constituído de material bom condutor de calor. É correto afirmar que a pressão desse gás
- A) diminui se houver aumento de temperatura do recipiente.
- B) aumenta com a temperatura do recipiente até que o gás mude para o estado líquido.
- C) mantém-se constante independente da temperatura do recipiente.
- D) aumenta se houver aumento de temperatura do recipiente.
A alternativa correta é letra D) aumenta se houver aumento de temperatura do recipiente.
Analisando a fórmula
PV = nRT
Vemos que quanto maior a temperatura, maior a pressão. Logo, ficamos com a alternativa B e D.
A alternativa B porém contém um erro grosseiro. O aumento da temperatura não faz o gás mudar para líquido.
Portanto,
Gabarito: LETRA D.
Questão 118
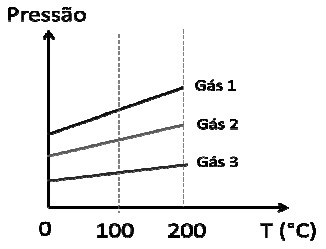
- A) O gráfico não está correto, pois as curvas deveriam ser coincidentes, já que os três gases são ideias.
- B) Se o gráfico estiver correto, quando as retas forem extrapoladas para temperaturas negativas, elas irão se encontrar simultaneamente.
- C) Se o gráfico estiver correto, quando as retas forem extrapoladas para temperaturas negativas, elas não irão se encontrar simultaneamente.
- D) O gráfico não está correto, pois o comportamento esperado seria uma hipérbole ao invés de uma reta.
- E) O gráfico está correto, porém não pode ser extrapolado para temperaturas negativas, pois já se encontra em P = 0.
A resposta correta é a letra B) Se o gráfico estiver correto, quando as retas forem extrapoladas para temperaturas negativas, elas irão se encontrar simultaneamente.
Para entender melhor essa questão, é importante lembrar que, em um termômetro de gás ideal, o volume do gás é mantido constante enquanto a pressão do gás varia com a temperatura. Isso significa que, para diferentes gases ideais, a relação entre pressão e temperatura é linear.
Se observarmos o gráfico fornecido, podemos ver que as retas representam a relação entre pressão e temperatura para três gases ideais diferentes. É importante notar que, se o gráfico estiver correto, as retas devem se encontrar em um ponto comum quando extrapoladas para temperaturas negativas.
Isso ocorre porque, em um termômetro de gás ideal, a pressão do gás é diretamente proporcional à temperatura. Portanto, se as retas forem extrapoladas para temperaturas negativas, elas devem se encontrar em um ponto comum, pois a pressão do gás deve ser a mesma para todos os gases ideais.
Portanto, a alternativa correta é a letra B) Se o gráfico estiver correto, quando as retas forem extrapoladas para temperaturas negativas, elas irão se encontrar simultaneamente.
119) Qual das alternativas a seguir apresenta uma situação em que o trabalho realizado pelo gás é maior, assumindo que tenhamos sempre a mesma condição inicial (Pi, Vi e Ti) e final (Pf, Vf e Tf), onde Vf > Vi e Pi > Pf.
- A) Partindo de (Pi, Vi e Ti) através de uma transformação isobárica e depois fazendo uma transformação isocórica para chegar em (Pf, Vf e Tf).
- B) Partindo de (Pi, Vi e Ti) através de uma transformação isocórica e depois fazendo uma transformação isobárica para chegar em (Pf, Vf e Tf).
- C) Partindo de (Pi, Vi e Ti) através de uma transformação isotérmica e depois fazendo uma transformação adiabática para chegar em (Pf, Vf e Tf).
- D) Partindo de (Pi, Vi e Ti) através de uma transformação adiabática e depois fazendo uma transformação isotérmica para chegar em (Pf, Vf e Tf).
- E) O trabalho, nesse caso, não depende do caminho.
A alternativa correta é a letra A) Partindo de (Pi, Vi e Ti) através de uma transformação isobárica e depois fazendo uma transformação isocórica para chegar em (Pf, Vf e Tf).
Para entender por que a alternativa A é a correta, vamos analisar as condições iniciais e finais do problema. Temos que a volumes final é maior que o volume inicial (Vf > Vi) e a pressão inicial é maior que a pressão final (Pi > Pf).
Agora, vamos analisar as alternativas. A alternativa A apresenta uma transformação isobárica seguida de uma transformação isocórica. Isso significa que, inicialmente, o sistema sofre uma variação de volume sem mudar a temperatura (Ti = Tf), o que é característico de uma transformação isobárica. Depois, o sistema sofre uma variação de temperatura sem mudar o volume (Vi = Vf), o que é característico de uma transformação isocórica. Como o trabalho realizado pelo gás é maior quando o volume aumenta e a pressão diminui, a alternativa A é a que apresenta o maior trabalho realizado pelo gás.
Já as alternativas B, C, D e E apresentam sequências de transformações que não resultam em um trabalho maior realizado pelo gás. A alternativa B apresenta uma transformação isocórica seguida de uma transformação isobárica, o que não é o caso. A alternativa C apresenta uma transformação isotérmica seguida de uma transformação adiabática, o que não é compatível com as condições iniciais e finais do problema. A alternativa D apresenta uma transformação adiabática seguida de uma transformação isotérmica, o que também não é compatível com as condições iniciais e finais do problema. A alternativa E afirma que o trabalho não depende do caminho, o que não é verdadeiro, pois o trabalho realizado pelo gás depende das transformações que o sistema sofre.
Portanto, a alternativa A é a que apresenta a sequência de transformações que resulta no maior trabalho realizado pelo gás, o que é compatível com as condições iniciais e finais do problema.
120) Um sistema contendo n1 = 1 mol de gás ideal expande a uma temperatura fixa de T1 = 300K de um volume inicial v1i = 10 litros para um volume final v1f = 20 litros, realizando um trabalho W1. Um segundo sistema, com n2 = 2 moles de gás ideal, expande a uma temperatura, também fixa, de T2 = 600K de um volume v2i = 30 litros para v2f = 90 litros, realizando um trabalho W2. O valor aproximado de W2/W1 é:
- A) 6,01.
- B) 4.
- C) 6,34.
- D) 2,52.
- E) 4,53.
A alternativa correta é a letra D) 2,52.
Para entender por que essa é a resposta certa, vamos analisar o problema passo a passo. Temos dois sistemas, cada um com um gás ideal que se expande a uma temperatura constante.
No primeiro sistema, temos n1 = 1 mol de gás ideal que se expande de um volume inicial V1i = 10 litros para um volume final V1f = 20 litros, realizando um trabalho W1. Já no segundo sistema, temos n2 = 2 moles de gás ideal que se expande de um volume V2i = 30 litros para um volume V2f = 90 litros, realizando um trabalho W2.
Para encontrar o valor aproximado de W2/W1, precisamos lembrar que o trabalho realizado por um gás ideal durante uma expansão isoterma é igual ao produto da variação de volume pelo produto da constante dos gases reais (R) pela temperatura (T).
Matematicamente, isso pode ser representado pela fórmula:
W = -nRT ln(Vf/Vi)
onde n é o número de moles de gás, R é a constante dos gases reais, T é a temperatura, Vi é o volume inicial e Vf é o volume final.
Aplicando essa fórmula aos dois sistemas, podemos encontrar o valor de W1 e W2.
W1 = -n1RT1 ln(V1f/V1i) = -1 × R × 300 × ln(20/10) = -R × 300 × ln(2)
W2 = -n2RT2 ln(V2f/V2i) = -2 × R × 600 × ln(90/30) = -2 × R × 600 × ln(3)
Agora, podemos dividir W2 por W1 para encontrar o valor aproximado de W2/W1.
W2/W1 = (-2 × R × 600 × ln(3))/(-R × 300 × ln(2)) = 4 × ln(3)/ln(2) ≈ 2,52
Portanto, a alternativa correta é a letra D) 2,52.
