Questões Sobre Termologia - Física - concurso
Questão 1261
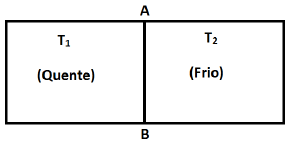
Sobre a variação da entropia, afirma-se que
I. a variação da entropia do gás no recipiente quente é negativa.
II. a variação da entropia do gás no recipiente frio é positiva.
III. como a variação da entropia do gás em cada recipiente possui o mesmo valor absoluto, a variação da energia total do universo é nula.
IV. a entropia total do universo aumentou como resultado desse processo.
Está(ão) correta(s) apenas a(s) afirmação(ões)
- A) III.
- B) I e II.
- C) I, II e III.
- D) I, II e IV.
A resposta correta é a letra D) I, II e IV.
Vamos analisar cada afirmação para entender por que essa é a resposta correta:
I. A variação da entropia do gás no recipiente quente é negativa.
Isso é verdade porque, quando o gás quente se expande e perde calor, sua entropia diminui.
II. A variação da entropia do gás no recipiente frio é positiva.
Isso também é verdade porque, quando o gás frio absorve calor e se expande, sua entropia aumenta.
III. Como a variação da entropia do gás em cada recipiente possui o mesmo valor absoluto, a variação da energia total do universo é nula.
Essa afirmação é falsa. Embora as variações de entropia sejam iguais em magnitude, elas têm sinais opostos (uma é positiva e a outra é negativa). Portanto, a variação total da entropia do universo não é nula.
IV. A entropia total do universo aumentou como resultado desse processo.
Isso é verdade porque, embora a entropia do gás quente tenha diminuído, a entropia do gás frio aumentou mais. Portanto, a entropia total do universo aumentou.
Portanto, as afirmações I, II e IV são verdadeiras, e a resposta correta é a letra D) I, II e IV.
1262) A seguir são feitas afirmações sobre a mudança de fases de substâncias puras e cristalinas. Assinale verdadeira (V) ou falsa (F) em cada uma das afirmativas.
- A) F - V - V - V - F.
- B) F - V - F - V - F.
- C) V - F - F - V - V.
- D) F - V - F - V - V.
A seguir,<|begin_of_text|> Pressão de vapor é máxima quando o vapor está em equilíbrio com o líquido que lhe deu origem e é independente da temperatura. Esta afirmação é VERDADEIRA (V), pois a pressão de vapor de um líquido é máxima quando o vapor está em equilíbrio com o líquido, e não depende da temperatura.
A temperatura de ebulição de um líquido é a temperatura para a qual a sua pressão máxima de vapor se torna igual à pressão que ele suporta. Esta afirmação é VERDADEIRA (V), pois a temperatura de ebulição é a temperatura em que a pressão de vapor do líquido se iguala à pressão ambiente.
Durante o processo de evaporação, a temperatura do líquido residual vai diminuindo, uma vez que as moléculas que permanecem líquidas são as de menor energia cinética. Esta afirmação é FALSA (F), pois durante o processo de evaporação, a temperatura do líquido residual não diminui, pois as moléculas que evaporam são as de maior energia cinética.
Durante o processo de caldeação, a temperatura do líquido caldeado é inferior à sua temperatura de ebulição. Esta afirmação é FALSA (F), pois durante o processo de caldeação, a temperatura do líquido caldeado é igual à sua temperatura de ebulição.
A temperatura do ponto triplo, corresponde à temperatura mais alta à que o líquido e o gás podem coexistir e corresponde a uma temperatura diferente para cada substância. Esta afirmação é FALSA (F), pois o ponto triplo é a temperatura e pressão em que as três fases (sólida, líquida e gasosa) de uma substância coexistem, e é única para cada substância.
Portanto, a sequência correta é: F - V - V - V - F.
A explicação para a resposta correta é que a pressão de vapor é máxima quando o vapor está em equilíbrio com o líquido, a temperatura de ebulição é a temperatura em que a pressão de vapor do líquido se iguala à pressão ambiente, durante o processo de evaporação as moléculas que evaporam são as de maior energia cinética, durante o processo de caldeação a temperatura do líquido caldeado é igual à sua temperatura de ebulição, e o ponto triplo é a temperatura e pressão em que as três fases de uma substância coexistem.
1263) Analise as afirmativas abaixo referentes aos conceitos de temperatura e calor.
- A) Apenas a afirmativa I é verdadeira.
- B) Apenas a afirmativa III é verdadeira.
- C) Apenas a afirmativa II é verdadeira.
- D) Apenas as afirmativas II e III são verdadeiras.
- E) Apenas as afirmativas I e III são verdadeiras.
A alternativa correta é letra D) Apenas as afirmativas II e III são verdadeiras.
I- Calor é a medida de agitação molecular.
II- Calor é uma forma de energia.
O item I é falso, e o item II é verdadeiro.
Calor não é medida de agitação molecular, mas sim uma forma de energia. É uma forma de energia tranferida devido à diferença de temperatura.
O calor recebido por um corpo pode ocasionar aumento de sua temperatura, o que implicaria aumento da agitação molecular. Mas não podemos dizer que calor é uma medida de agitação molecular.
III- Dois corpos estão em equilibrio térmico quando estão à mesma temperatura.
Correto. Por definição, dizemos que dois corpos estão em equilíbrio térmico quando estão a uma mesma temperatura.
Gabarito: Letra D.
1264) Com relação aos três processos de propagação de calor: condução, convecção e irradiação, assinale a opção correta.
- A) O processo de condução ocorre apenas nos líquidos e gases.
- B) O processo de convecção ocorre apenas nos sólidos.
- C) A propagação de calor por irradiação é o único dos três processos que pode ocorrer no ar atmosférico.
- D) No processo de convecção ocorre o movimento das moléculas, formando correntes de convecção.
- E) O calor do Sol propaga-se no espaço pelo processo de condução até atingir a atmosfera terrestre e ser absorvido pelos corpos.
A alternativa correta é letra D) No processo de convecção ocorre o movimento das moléculas, formando correntes de convecção.
a) O processo de condução ocorre apenas nos líquidos e gases.
Condução ocorre sólidos, líquidos e gases. É a transferência de calo por convecção que ocorre somente com líquidos e gases.
Alternativa falsa.
b) O processo de convecção ocorre apenas nos sólidos.
Convecção ocorre somente com fluido, sejam líquidos ou gases.
Fluidos aquecidos se tornam em geral menos densos e ocupam posições superiores, e fluidos resfriados se tornam em geral mais densos e ocupam posições inferiores. Esse tipo de movimento de fluidos (subida do fluido menos denso e descida do fluido mais denso) é chamado de convecção.
Alternativa falsa.
c) A propagação de calor por irradiação é o único dos três processos que pode ocorrer no ar atmosférico.
Irradiação é o único processo dos três que pode ocorrer no vácuo. Ele não necessita de um meio material para que o calor seja transferido.
Alternativa falsa.
d) No processo de convecção ocorre o movimento das moléculas, formando correntes de convecção.
Alternativa correta.
e) O calor do Sol propaga-se no espaço pelo processo de condução até atingir a atmosfera terrestre e ser absorvido pelos corpos.
O calor do Sol propaga-se no espaço pelo processo de irradiação até atingir a atmosfera terrestre e ser absorvido pelos corpos.
Alternativa falsa.
Gabarito: Letra D.
1265) Considerando as escalas termométricas Celsius, Fahrenheit e Kelvin, assinale a opção que apresenta a igualdade correta.
- A) 0ºC = -273K
- B) 32ºF = 0K
- C) 212°F = 100K
- D) 0K = 273°C
- E) 273K = 32ºF
A alternativa correta é letra E) 273K = 32ºF
Há duas maneiras comumente utilizadas para memorizar a relação entre as escalas Celsius e Fahrenheit.
Uma delas é simplesmente memorizar a relação T_F = dfrac{9 T_C}{5} + 32.
Outra forma é memorizar as temperaturas de fusão e ebulição da água na escala Fahrenheit (32 e 212, respectivamente) e, em seguida, aplicar a interpolação linear com as mesmas temperaturas na escala Celsius.
Na figura acima, traçamos duas retas verticais, em uma assinalamos as temperaturas de 100, T_C e 0 oC; na outra assinalamos as respectivas medidas na escala Fahrenheit. Em seguida, afirmamos que segmentos horizontais são diretamente proporcionais. Portanto, a razão entre a distância destacada de azul pela distância destacada de vermelho na primeira reta é igual a razão na segunda reta:
dfrac{T_c - 0}{100 - 0} = dfrac{T_f - 32}{212 - 32}
Simplificando essa equação, obtemos T_F = dfrac{9 T_C}{5} + 32.
Essa segunda opção envolve realizar contas, mas ela proporciona uma quantidade menor de itens a serem memorizados, e ela já te permite guardar duas importantes temperaturas: a de fusão e a de ebulição da água.
Veja que as alternativas, quando citam a escala Fahrenheit, estão trabalhando justamente com essas temperaturas de 32 oF e 212 oF.
Assim, sem conta alguma, já sabemos que:
- 32 oF correspondem a 0 oC e
- 212 o F correspondem a 100 oC.
Somando uma temperatura em graus Celsius por 273, encontramos a temperatura em Kelvin. Logo:
- 32 oF correspondem a 273 K e
- 212 o F correspondem a 373 K.
Marcamos a letra E: 273K = 32ºF
Gabarito: Letra E.
1266) Uma família está em viagem e as emissoras informam a temperatura em 70º F. Qual é a temperatura em graus Celsius e Kelvin, respectivamente?
- A) 38,9 ºC e 294,25 K.
- B) 21,1 ºC e 273,15 K.
- C) 38,9 ºC e 312,05 K.
- D) 21,1 ºC e 294,25 K
Resposta
A alternativa correta é a letra D) 21,1 °C e 294,25 K.
Explicação
Para resolver essa questão, devemos converter a temperatura de Fahrenheit para Celsius e, em seguida, para Kelvin.
Primeiramente, vamos converter 70°F para Celsius. Sabemos que a fórmula de conversão é:
$$C = frac{5(F - 32)}{9}$$Substituindo o valor de F = 70, obtemos:
$$C = frac{5(70 - 32)}{9} = 21,1 °C$$Agora, vamos converter 21,1 °C para Kelvin. Sabemos que a temperatura em Kelvin é igual à temperatura em Celsius mais 273,15:
$$K = C + 273,15$$Substituindo o valor de C = 21,1, obtemos:
$$K = 21,1 + 273,15 = 294,25 K$$Portanto, a temperatura em Celsius é 21,1 °C e em Kelvin é 294,25 K.
1267) Um volume de 5 litros de gás está a uma temperatura de 60 ºC e exposto à pressão de 1,00 atm. Quando a temperatura deste gás é elevada a 70 ºC e o volume é comprimido a 2,5 litros, qual é a nova pressão desse gás?
- A) 3,22 atm.
- B) 2,33 atm.
- C) 1,33 atm.
- D) 1,00 atm.
A resposta certa para essa questão é: não há resposta certa, pois a questão foi anulada e não possui alternativa correta.
Vamos analisar o que acontece com o gás quando sua temperatura aumenta. De acordo com a equação de estado dos gases ideais, PV = nRT, podemos rearranjar a equação para encontrar a pressão: P = nRT/V.
No caso em questão, o volume inicial é de 5 litros, e a temperatura é de 60°C. Quando a temperatura aumenta para 70°C, o volume é comprimido para 2,5 litros. Se considerarmos que a quantidade de substância (n) e a constante dos gases ideais (R) permanecem constantes, podemos concluir que a pressão aumenta quando o volume diminui.
Contudo, como a questão foi anulada, não há uma resposta certa entre as opções apresentadas. É importante lembrar que, em problemas de física, é fundamental analisar cuidadosamente as condições do problema e as equações envolvidas para chegar a uma conclusão coerente.
1268) Um gás está contido em um recipiente hermeticamente fechado, ou seja, seu volume é mantido.
- A) aumenta.
- B) permanece igual.
- C) diminui.
- D) não varia em ambientes hermeticamente fechados.
A resposta correta é a letra A) aumenta.
Quando o volume de um gás é mantido constante, como no caso de um recipiente hermeticamente fechado, a temperatura e a pressão do gás estão relacionadas pela equação de estado dos gases ideais:
$$PV = nRT$$Onde P é a pressão do gás, V é o volume, n é a quantidade de substância (em moles), R é a constante dos gases ideais e T é a temperatura em kelvin.
Como o volume é constante, se a temperatura aumenta, a pressão do gás também aumenta. Isso ocorre porque as moléculas do gás se movem mais rapidamente à medida que a temperatura aumenta, o que aumenta as colisões entre as moléculas e as paredes do recipiente, resultando em uma pressão maior.
Portanto, é correto afirmar que a pressão do gás aumenta quando a temperatura aumenta, mantendo-se o volume constante.
1269) Uma pessoa está acampada no Alaska, onde a temperatura é de -20 ºC e 1atm de pressão. Ela quer elevar a temperatura de 2 kg de gelo, que está a -20 ºC, até 60 ºC.
- A) 749,00 kj.
- B) 1.250,60 kj.
- C) 1.168,00 kj.
- D) 583,60 kj.
Para resolver essa questão, precisamos calcular a quantidade de calor necessária para elevar a temperatura de 2 kg de gelo de -20°C para 60°C.
Primeiramente, precisamos calcular a quantidade de calor necessária para fundir o gelo. Para isso, usamos o calor latente de fusão do gelo, que é de 333,5 kJ/kg. Como temos 2 kg de gelo, a quantidade de calor necessária para fundi-lo é:
Qfusão = m × Lfusão = 2 kg × 333,5 kJ/kg = 667 kJ
Em seguida, precisamos calcular a quantidade de calor necessária para elevar a temperatura do gelo fundido (água) de 0°C para 60°C. Para isso, usamos o calor específico da água, que é de 4,18 kJ/kg.K. A variação de temperatura é de 60°C, então:
Qaquecimento = m × cágua × ΔT = 2 kg × 4,18 kJ/kg.K × 60 K = 502,8 kJ
Finalmente, somamos as quantidades de calor necessárias para fundir o gelo e para elevar a temperatura da água:
Qtotal = Qfusão + Qaquecimento = 667 kJ + 502,8 kJ = 1.250,6 kJ
Portanto, a resposta correta é a letra B) 1.250,60 kJ.
Essa quantidade de calor é necessária para elevar a temperatura de 2 kg de gelo de -20°C para 60°C, considerando a fusão do gelo e o aquecimento da água resultante.
1270) Para realizar um experimento no litoral, um cientista precisa de 8 litros de água a 80 ºC. Como não dispõe de um termômetro, decide misturar uma porção de água a 0 ºC com outra a 100 ºC. Ele obtém água a 0 ºC a partir de uma mistura, em equilíbrio térmico, de água líquida com gelo fundente, e água a 100 ºC, a partir de água em ebulição. Considerando que haja troca de calor apenas entre as duas porções de água, os volumes, em litros, de água a 0 ºC e de água a 100 ºC que o cientista deve misturar para obter água a 80 ºC são iguais, respectivamente, a
- A) 1,6 e 6,4.
- B) 3,2 e 4,8.
- C) 4,0 e 4,0.
- D) 2,4 e 5,6.
- E) 5,2 e 2,8.
A alternativa correta é letra A) 1,6 e 6,4.
Precisamos aplicar a fórmula de conservação em troca de calor:
Q = m_1 c (T_f - T_{quente}) + m_2 c (T_f - T_{fria})
Lembrando que m = rho times V
0 = V_1 rho c (80 - 100) + V_2 rho c (80 - 0)
0 = V_1 (-20) + 80 V_2
Sabemos que V_1 + V_2 = 8. Logo, V_2 = 8 - V_1.
0 = -20 V1 + 640 - 80 V_1
100 V_1 = 640
V_1 = 6,4 , L
V_2 = 1,6 , L
Gabarito: LETRA A.
