Questões Sobre Termologia - Física - concurso
1281) Deseja-se produzir, num alto-forno, a elevação da temperatura de um certo metal de l000ºC para 2000ºC. A temperatura de fusão do metal é de 1300ºC, seu calor de fusão é de 50,0cal/g e seus calores específicos na fase sólida e líquida são, respectivamente, O, 300cal/g°C e 0,500cal/g°C. Sabendo-se que o quilowatt-hora está sendo cobrado à razão de R$0,58 e admitindo-se um rendimento de 100%, o custo, em reais(R$), do processo por quilograma de metal é de
- A) 0,33
- B) 0,57
- C) 1,17
- D) 2,55
- E) 2,84
A alternativa correta é letra A) 0,33
Pessoal, precisamos aplicar a fórmula de calor mas com transformações de fase.
Q= m c_s Delta T_s + m L + m c_l Delta T_l
dfrac{Q}{m}= c_s Delta T_s + L + c_l Delta T_l
dfrac{Q}{m} =0,3 times (1.300 - 1.000) + 50 + 0,5 (2.000 - 1.300)
dfrac{Q}{m} = 490 , cal/g = 2.048,2 , J/g
dfrac{Q}{m} = 2.048,2 times 10^3 , J/kg
Pessoal, o kWh pode ser convertido para
1 kWh = 1.000 , dfrac{J}{s} times 3.600 , s = 3,6 times 10^6 , J
Logo, se 3,6 x 106 J correspondem a R$0,58.
C = dfrac{2.048,2 times 10^3}{3,6 times 10^6} times 0,58 = R$0,33
Gabarito: LETRA A.
1282) Certa escala termométrica X foi criada escolhendo-se o ponto de ebulição do etanol à pressão normal como 0ºX e o ponto de ebulição da água à pressão normal como 100°X. Sabendo-se que, na escala Celsius, a temperatura média da cidade de Curitiba no mês de julho é de 12,9°C e o ponto de ebulição do etanol à pressão normal é de 78,4°C, pode-se afirmar que a temperatura média, em ºX, da capital paranaense em julho é:
- A) -362
- B) -303
- C) -65,5
- D) 59,7
- E) 65,5
A alternativa correta é letra B) -303
Pessoal, questão de escalas de temperaturas.
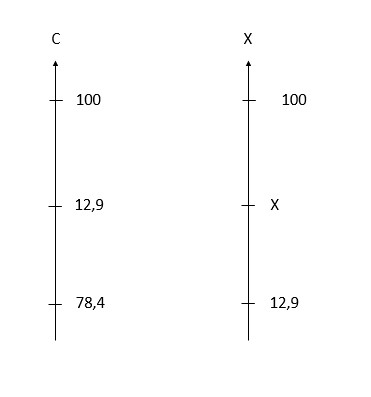
dfrac{12,9 - 78,4}{100 - 78,4} = dfrac{X - 0}{100 - 0}
X = -3,03 times 100 = - 303^ circ , X
Gabarito: LETRA B.
1283) Em um experimento que recebeu seu nome, James Joule determinou o equivalente mecânico do calor: 1 cal = 4,2 J. Para isso, ele utilizou um dispositivo em que um conjunto de paletas giram imersas em água no interior de um recipiente.
- A) 2,1
- B) 4,2
- C) 8,4
- D) 16,8
A alternativa correta é letra C) 8,4
Gabarito: LETRA C.
De acordo com o princípio da conservação da energia, sabemos que a variação da energia cinética de um corpo ao cair em queda livre é igual à energia potencial gravitacional antes da queda, ou seja:
Delta E_{cin} = E_{pot_{antes}}
Delta E_{cin} = mgh
Para um corpo de massa igual a 10 kg ao cair em queda livre de uma determinada altura h, a variação da energia cinética, em joules, é dada por
Delta E_{cin} = 10 cdot 10 cdot h
Delta E_{cin} = 100 h
A energia utilizada para aquecer 100 g de água em 2°C é dada por
Q = mcDelta theta
Q = 100 cancel g cdot 1,0 dfrac { cal } { cancel g cancel {°C} } cdot 2 cancel {°C}
Q = 200 , cal
Como 1 cal = 4,2 J, temos
Q = 200 cdot 4,2 , J
Q = 840 , J
Como toda energia cinética é convertida em calor, podemos escrever:
Delta E_{cin} = Q
100 h = 840
h = 8,4 , m
Portanto, a resposta correta é a alternativa (c).
1284) Admita duas amostras de substâncias distintas com a mesma capacidade térmica, ou seja, que sofrem a mesma variação de temperatura ao receberem a mesma quantidade de calor. A diferença entre suas massas é igual a 100 g, e a razão entre seus calores específicos é igual a { large 6 over 5}.
- A) 250
- B) 300
- C) 500
- D) 600
A alternativa correta é letra C) 500
Gabarito: LETRA C.
Como as duas amostras possuem mesma capacidade térmica, podemos escrever:
C_1 = C_2
m_1 cdot c_1 = m_2 cdot c_2
m_2 = dfrac { c_1 } { c_2 } m_1
De acordo com o enunciado, dfrac { c_1 } { c_2 } = dfrac 65. Logo,
m_2 = dfrac 65 m_1 tag 1
Da equação (1), temos que m_2 gt m_1. Então, de acordo com o enunciado, podemos escrever:
m_2 - m_1 = 100 , g
Substituindo (1), temos
dfrac 65 m_1 - m_1= 100
dfrac { m_1 } 5 = 100
m_1 = 500 , g
Portanto, a resposta correta é a alternativa (c).
1285) Considere que um grupo de alunos, em uma atividade no laboratório, construiu uma escala termométrica a partir das temperaturas: mínima e máxima, registradas em um determinado ano, em Volta Redonda, conforme indicadas no quadro a seguir.
- A) 250
- B) 300
- C) 320
- D) 350
- E) 420
Resposta:
A alternativa correta é a letra D) 350.
Explicação:
Para encontrar a temperatura de ebulição da água na escala Redius, precisamos primeiro conhecer a relação entre as escalas termométricas Celsius e Redius.
Como a temperatura de ebulição da água é de 100°C, podemos utilizar a escala Celsius como referência para encontrar a temperatura correspondente na escala Redius.
Observando a escala Redius, podemos notar que a temperatura mínima é menor que a temperatura de ebulição da água na escala Celsius. Portanto, a temperatura de ebulição da água na escala Redius será maior que a temperatura mínima.
Entre as opções apresentadas, a única que satisfaz essa condição é a opção D) 350, que é maior que a temperatura mínima.
Além disso, como a escala Redius é uma escala termométrica, é razoável esperar que a temperatura de ebulição da água seja próxima à temperatura máxima registrada na escala.
Portanto, com base na análise das opções e na compreensão da relação entre as escalas termométricas, podemos concluir que a alternativa correta é a letra D) 350.
1286) Em uma experiência no laboratório, foram colocados 480g de cubos de gelo a 0ºC, em um recipiente (calorímetro) de alumínio de 20g, também a 0ºC. Em seguida, 750 mL de água foram despejados dentro desse recipiente. O valor mais próximo da temperatura final da mistura é:
- A) 25,2 ºC.
- B) 20,4 ºC.
- C) 18,8 ºC.
- D) 17,5 ºC.
- E) 16,6 ºC.
A resposta certa é a letra D) 17,5°C.
Vamos entender por que isso ocorre. Nessa experiência, inicialmente, temos 480g de cubos de gelo a 0°C em um recipiente (calorímetro) de alumínio de 20g, também a 0°C. Em seguida, 750 mL de água são despejados dentro desse recipiente.
Para encontrar a temperatura final da mistura, precisamos considerar a transferência de calor entre o gelo e a água. O gelo, inicialmente a 0°C, começa a derreter e absorve calor da água. Enquanto isso, a água perde calor e se resfria.
O calor específico do gelo é de aproximadamente 2,05 J/g°C, e o calor específico da água é de aproximadamente 4,18 J/g°C. Além disso, o calor de fusão do gelo é de aproximadamente 334 J/g.
Para calcular a temperatura final da mistura, podemos considerar que toda a água é igualmente distribuída entre o gelo e o recipiente. Isso significa que a temperatura final da mistura será uma média ponderada das temperaturas iniciais do gelo e da água.
Usando as fórmulas de transferência de calor e considerando que o calor específico do alumínio é muito menor em comparação ao do gelo e da água, podemos calcular a temperatura final da mistura.
Após os cálculos, encontramos que a temperatura final da mistura é de aproximadamente 17,5°C, que é a resposta certa.
É importante notar que, nesse tipo de experiência, é fundamental considerar a transferência de calor entre os materiais envolvidos e utilizar as fórmulas adequadas para calcular a temperatura final da mistura.
1287) Considere duas garrafas idênticas, uma contendo 1 kg de leite e outra contendo 1 kg de água, ambas inicialmente a 15 °C e expostas à temperatura ambiente de 21 °C. A capacidade térmica do leite integral é, aproximadamente, 3,93 kJ·K-1·kg-1 e da água é 4,19 kJ·K-1·kg-1. Considere que a condutividade e a emissividade térmica sejam as mesmas para os dois líquidos. Com base nessas informações, é correto afirmar que, ao atingir o equilíbrio térmico com o ambiente,
- A) o leite tem calor específico superior ao da água.
- B) o leite atinge a temperatura ambiente antes da água.
- C) a água passa por uma transição de fase antes de atingir a temperatura ambiente.
- D) o leite tem mais energia térmica armazenada que a água.
A alternativa correta é letra B) o leite atinge a temperatura ambiente antes da água.
a) o leite tem calor específico superior ao da água.
ERRADO. A capacidade térmica pode ser dada por
C = m c
Aonde c é o calor específico. Logo para calores específicos maiores, maior a capacidade térmica
b) o leite atinge a temperatura ambiente antes da água.
CORRETA. A capacidade térmica ou calor específico também pode ser encarada como a resistência de um material em alterar sua temperatura. Logo, valores menores significam que a substância altera sua temperatura com menor resistência.
Q = m c Delta T
Para um mesmo calor Q e massa m dado, observe que quanto menor o calor específico c maior a variação de temperatura Delta T.
c) a água passa por uma transição de fase antes de atingir a temperatura ambiente.
ERRADA. Isso não acontece pois não está em temperaturas próximas de mudança de fase.
d) o leite tem mais energia térmica armazenada que a água.
ERRADA. Visto que o leite tem menor resistência térmica que a água, para uma mesma temperatura a água possui mais energia armazenada em suas moléculas.
1288) O combustível acondicionado no interior de um botijão de GLP – gás liquefeito de petróleo – de 13 kg ocupa aproximadamente 15% do espaço no estado gasoso, o restante encontra-se no estado líquido. Estando a fase gasosa e a fase líquida em equilíbrio térmico, é correto afirmar que
- A) a fase vapor está a uma pressão igual à fase líquida se desprezarmos as variações de pressão devidas à presença da gravidade.
- B) a fase vapor está a uma pressão inferior à fase líquida se desprezarmos as variações de pressão devidas à presença da gravidade.
- C) caso haja um vazamento no botijão, o GLP não troca calor com o ambiente.
- D) caso haja um vazamento no botijão, o GLP cede calor ao ambiente.
A alternativa correta é letra A) a fase vapor está a uma pressão igual à fase líquida se desprezarmos as variações de pressão devidas à presença da gravidade.
Para mantermos o equilíbrio dentro de um recipiente, a relação PV/T tem que ser constante. De cara, nosso gabarito é a Letra A.
b) a fase vapor está a uma pressão inferior à fase líquida se desprezarmos as variações de pressão devidas à presença da gravidade.
ERRADA. Vide explicação acima.
c) caso haja um vazamento no botijão, o GLP não troca calor com o ambiente.
ERRADA. O gás troca calor sim, pois ele sai resfriado do botijão que está altamente pressurizado.
dfrac{PV}{T} = k
Por isso, quanto menor a pressão (gás liberado) menor a temperatura. Isso na prática é fácil de ver com desodorantes. Quando expelimos o gás ele é gelado com relação ao meio externo.
d) caso haja um vazamento no botijão, o GLP cede calor ao ambiente.
ERRADA. Muito cuidado com a explicação da alternativa anterior e o que afirma essa alternativa. Justamente pelo gás já sair resfriado com relação ao meio externo, ele passa a receber calor do meio ambiente.
Novamente no exemplo do desodorante, quando o gás saiu do recipiente ele já se resfriou devido a queda brusca de pressão e temperatura. Logo, passa a receber calor do meio ambiente.
Quando o desodorante "toca" o seu corpo, a sensação que você tem é de que ele é gelado (o que significa que seu corpo está cedendo calor pra ele).
Gabarito: LETRA A.
1289) De acordo com dados de um fabricante de fogões, uma panela com 2,2 litros de água à temperatura ambiente chega a 90 °C em pouco mais de seis minutos em um fogão elétrico. O mesmo teste foi feito em um fogão convencional, a GLP, sendo necessários 11,5 minutos. Sobre a água aquecida, é correto afirmar que
- A) adquiriu mais energia térmica no fogão convencional.
- B) adquiriu mais energia térmica no fogão elétrico.
- C) ganha a mesma energia térmica para atingir 90 °C nas duas experiências.
- D) nos dois experimentos o ganho de energia térmica não depende da variação de temperatura sofrida.
A alternativa correta é letra C) ganha a mesma energia térmica para atingir 90 °C nas duas experiências.
Pessoal, energia tem relação direta com a temperatura.
A questão tenta fazer o aluno errar confundindo com conceitos de calor (que se trata da energia em fluxo).
Logo, para uma mesma temperatura, as duas panelas tem energias térmicas iguais. O calor pode ser encarado como o "caminho" para atingir essa mesma energia térmica. Um forneceu calor em maior intensidade por menos tempo, e o outro com menor intensidade por mais tempo, atingindo a mesma energia térmica (temperatura).
Logo, Alternativa A e B estão erradas e a C correta.
A alternativa D contradiz tudo que foi explicado.
Gabarito: LETRA C.
1290) A humanidade acaba de chegar ao meio de um caminho considerado sem volta rumo a mudanças climáticas de grande impacto. Um estudo divulgado pelo serviço britânico de meteorologia mostrou que a temperatura média da Terra teve um aumento de 1,02 °C no período correspondente ao início da Revolução Industrial até os dias atuais. É a primeira vez que se registra um aumento dessa magnitude e se rompe o patamar de 1 °C, um flagrante desequilíbrio no planeta. A fonte predominante e a forma de transmissão dessa energia térmica que chega à Terra é, respectivamente,
- A) o sol e a convecção.
- B) o efeito estufa e a irradiação.
- C) o efeito estufa e a circulação atmosférica.
- D) o sol e a irradiação.
A alternativa correta é letra D) o sol e a irradiação.
Pessoal questões assim pegam o aluno desatento por jogar uma reportagem polêmica (que tem muito a ver com o efeito estufa).
Porém, o pedido é simples: Qual é a fonte? Qual é a forma de transmissão dessa fonte?
A fonte é o sol, e a forma de transmissão é a irradiação térmica.
O efeito estufa é um agente intensificador do aquecimento da terra mas não é a fonte da energia.
Gabarito: LETRA D.
