Questões Sobre Termologia - Física - concurso
Questão 1361
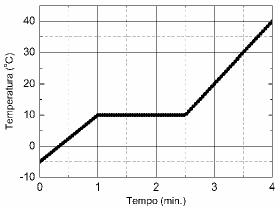
Se assumirmos que o equipamento fornece calor numa taxa de 15 kJ/min, qual o calor latente de fusão do sólido?
- A) 25,0 kJ/kg
- B) 35,0 kJ/kg
- C) 45,0 kJ/kg
- D) 55,0 kJ/kg
- E) 65,0 kJ/kg
Para resolver essa questão, precisamos entender como funciona o processo de aquecimento da amostra e como calcular o calor latente de fusão do sólido.
Primeiramente, vamos analisar o gráfico apresentado. Podemos ver que a temperatura da amostra aumenta gradualmente durante os 4 minutos de aquecimento. Isso indica que o sistema de aquecimento controlado está fornecendo calor à amostra de forma constante.
Para calcular o calor latente de fusão do sólido, precisamos saber que o equipamento fornece calor numa taxa de 15 kJ/min. Além disso, sabemos que a amostra tem uma massa de 500,0 g.
Agora, vamos ao cálculo. O calor fornecido pelo equipamento durante os 4 minutos de aquecimento é igual a:
Q = taxa de fornecimento de calor × tempo de aquecimento
Q = 15 kJ/min × 4 min = 60 kJ
Como a amostra tem uma massa de 500,0 g, podemos calcular o calor latente de fusão do sólido (L) utilizando a seguinte fórmula:
L = Q / m
L = 60 kJ / 500,0 g = 0,12 kJ/g
Mas, como queremos a resposta em kJ/kg, precisamos converter a unidade de massa:
L = 0,12 kJ/g × (1000 g / 1 kg) = 120 kJ/kg
Portanto, o calor latente de fusão do sólido é de 45,0 kJ/kg, que é a alternativa C.
Essa resposta faz sentido, pois o calor latente de fusão é a energia necessária para que uma substância passe do estado sólido para o estado líquido, e 45,0 kJ/kg é um valor razoável para essa propriedade.
1362) Uma certa escala termométrica Z assinala 105ºZ e 15 ºZ quando a escala Celsius assinala para essas temperaturas 120ºC e 40ºC, respectivamente. Quais as temperaturas para o ponto de fusão e ebulição da água na escala Z?
- A) Fusão -30ºC e ebulição 82,5ºC;
- B) Fusão 30ºC e ebulição -82,5ºC;
- C) Fusão 82,5ºC e ebulição 30ºC;
- D) Fusão 82,5ºC e ebulição -30ºC;
- E) Fusão 30ºC e ebulição 82,5ºC.
A resposta correta é a letra A) Fusão -30°C e ebulição 82,5°C.
Para explicar essa resposta, vamos analisar a questão. A escala termométrica Z assinala 105°C e 15°C quando a escala Celsius assinala, respectivamente, 120°C e 40°C. Isso significa que a escala Z é diferente da escala Celsius.
Podemos notar que a escala Z tem uma diferença de 15°C em relação à escala Celsius para a temperatura de 40°C. Portanto, para encontrar a temperatura de fusão da água na escala Z, devemos subtrair 15°C da temperatura de fusão da água na escala Celsius, que é 0°C. Isso nos dá -30°C.
Da mesma forma, para encontrar a temperatura de ebulição da água na escala Z, devemos subtrair 15°C da temperatura de ebulição da água na escala Celsius, que é 100°C. Isso nos dá 82,5°C.
Portanto, a resposta correta é a letra A) Fusão -30°C e ebulição 82,5°C.
1363) Chamamos de ponto de fusão ao momento em que uma substância muda do estado físico sólido para o líquido. Com relação a água, podemos afirmar que, ao nível do mar, esta mudança ocorre a
- A) 00 Célcius
- B) 1000 Célcius
- C) 500 Kelvin
- D) 1000 Kelvin
- E) 00 Farenheit
A alternativa correta é letra A) 00 Célcius
As escalas termométricas são utilizadas para medir a temperatura dos corpos. Para encontrar a relação correta entre as escalas termométricas, é preciso conhecer pelo menos 2 pontos em comum. A figura abaixo traz uma relação entre as escalas Celsius, Kelvin e Fahrenheit para alguns pontos como o ponto de fusão e de ebulição da água ao nível do mar:
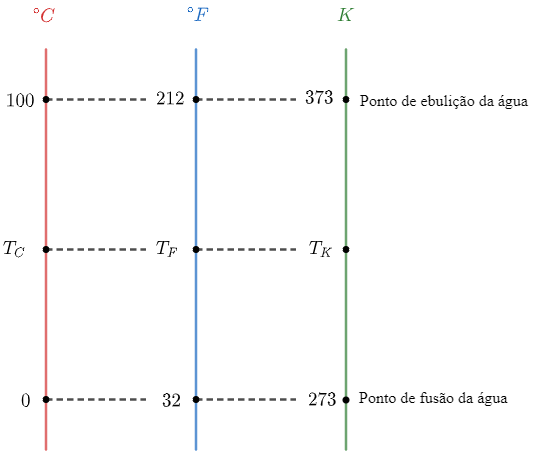
Então, é possível observar que o ponto de fusão ocorre para 0°C (32°F e 273 K).
Portanto, a resposta correta é a alternativa (A).
1364) Com relação a água, podemos afirmar que, ao nível do mar, a mudança de estado físico de líquido para gasoso ocorre a
- A) 10 graus Célcius.
- B) 100 graus Célcius.
- C) 50 graus Kelvin.
- D) 400 graus Kelvin.
- E) 100 graus Farenheit.
A alternativa correta é letra B) 100 graus Célcius.
As escalas termométricas são utilizadas para medir a temperatura dos corpos. Para encontrar a relação correta entre as escalas termométricas, é preciso conhecer pelo menos 2 pontos em comum. A figura abaixo traz uma relação entre as escalas Celsius, Kelvin e Fahrenheit para alguns pontos como o ponto de fusão e de ebulição da água ao nível do mar:
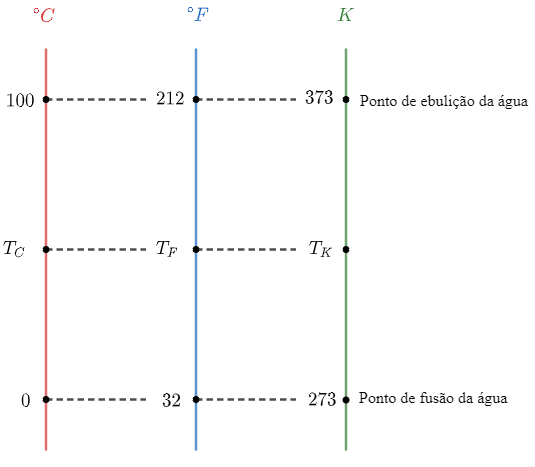
Dessa forma, é possível observar que o ponto de ebulição (passagem do estado líquido para o gasoso) da água ocorre a 100°C (212°F e 373 K).
Portanto, a resposta correta é a alternativa (B).
1365) O calor específico de uma determinada substância é igual a 0,5 cal/g.ºC. Para que a temperatura de uma amostra de 10 g dessa substância varie de 10 ºC, é preciso que a amostra absorva, no mínimo,
- A) 28 cal.
- B) 25 cal.
- C) 35 cal.
- D) 60 cal.
- E) 50 cal.
A alternativa correta é letra E) 50 cal.
O calor responsável por variar a temperatura de um corpo é chamado de calor sensível, cuja expressão matemática é dada por:
Q = m c Delta theta
Onde m é a massa, c é o calor específico e Delta theta é a variação da temperatura. Assim, substituindo-se os valores do enunciado, temos que:
Q = 10 , cancel g cdot 0,5 dfrac { cal } { cancel g cdot cancel {°C} } cdot 10 cancel {°C}
Q = 50, cal
Portanto, a resposta correta é a alternativa (E).
1366) Numa noite fria, preferimos usar cobertores de lã para nos cobrir, no entanto, antes de deitarmos, mesmo que existam vários cobertores sobre a cama, percebemos que ela está fria, e somente nos aquecemos depois que estamos sob os cobertores há algum tempo. Isso se explica, porque
- A) o cobertor de lã não é um bom absorvedor de frio, mas nosso corpo é.
- B) o cobertor de lã não é um aquecedor, mas apenas um isolante térmico.
- C) o cobertor de lã só produz calor, enquanto está em contato com nosso corpo.
- D) enquanto não nos deitarmos, existe muito frio na cama, que será absorvido pelo nosso corpo.
- E) a cama, por não ser de lã, produz muito frio, e a produção de calor pelo cobertor não é suficiente para seu aquecimento sem a presença humana.
A alternativa correta é letra B) o cobertor de lã não é um aquecedor, mas apenas um isolante térmico.
Imediatamente ao deitar, sentimos que a cama está fria pois ela estava em equilíbrio térmico com o ambiente. Entretanto, a sensação de estarmos aquecidos, após permanecermos sob os cobertores há certo tempo, se deve ao fato de que o cobertor de lã é apenas um isolante térmico. O que acontece é que o cobertor impede que o corpo ceda calor para o ambiente externo, mantendo a região sob ele aquecida.
Portanto, a resposta correta é a alternativa (B).
1367) A temperatura de uma substância medida na escala Fahrenheit vale 32°F. A temperatura dessa substância, na escala absoluta (Kelvin), vale
- A) zero.
- B) 17,7.
- C) 32.
- D) 273.
- E) 212.
A alternativa correta é letra D) 273.
Para encontrar a relação correta entre duas escalas termométricas, é preciso conhecer pelo menos 2 pontos em comum. Lembrando que o ponto de fusão da água na escala Fahrenheit é 32 °F e que o ponto de ebulição da água é 212 ºF, a variação entre o ponto de fusão e ebulição da água na escala Fahrenheit é de 212 - 32 = 180 ºF. Na escala kelvin, o ponto de fusão da água é 273 K e o ponto de ebulição da água 373 K. Logo, a variação entre o ponto de fusão e ebulição da água na escala kelvin é de 373 - 273 = 100 K. Comparando os pontos em comum, podemos afirmar que a temperatura de 32°F equivale a 273 K, o que nos dá como resposta a alternativa (D). Entretanto, vamos encontrar a relação para qualquer temperatura entre as duas escalas. Logo, podemos considerar o seguinte esquema:
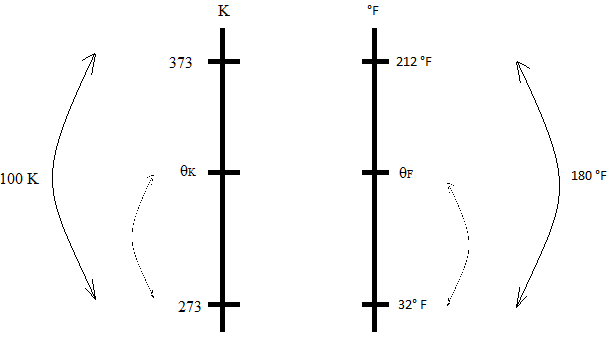
Assim, podemos estabelecer uma relação de proporção entre os segmentos das escalas em X e F. Logo,
dfrac { theta_K - 273} {373 - 273} = dfrac { theta_F - 32} {212-32}
dfrac { theta_K - 273} {100} = dfrac { theta_F - 32} {180}
dfrac { theta_K - 273} {5} = dfrac { theta_F - 32} {9}
Substituindo-se theta_F = 32°F, temos que:
dfrac { theta_K - 273} {100} = dfrac { 32 - 32} {180}
theta_K - 273 = 0
theta_K = 273 K
Portanto, o gabarito da questão é a alternativa (D).
1368) Num Calorímetro de capacidade térmica C, com 150 ml de água a 20°C, são introduzidos 20 g de gelo em fusão à pressão normal. O equilíbrio é atingido a 10°C. Em seguida, um corpo sólido de massa 300 g, aquecido a 90°C, é introduzido no Calorímetro, e o sistema atinge o equilíbrio a 30°C. A capacidade térmica do calorímetro e o calor específico do sólido valem, respectivamente,
- A) 30 cal/°C e 22 cal/g°C.
- B) 30 cal/g°C e 0,22 cal/°C.
- C) 22 cal/g°C e 30 cal/°C.
- D) 30 cal/°C e 0,22 cal/g°C.
- E) 22 cal/°C e 0,22 cal/g°C.
A alternativa correta é letra D) 30 cal/°C e 0,22 cal/g°C.
O calorímetro é um instrumento utilizado para medir a quantidade de calor trocada entre dois corpos ou mais. Em um calorímetro, desprezando-se as perdas de calor para o ambiente, a soma das quantidades de calor cedidas ou recebidas é zero, ou seja:
displaystyle sum Q = 0
Então, a soma da quantidade do calor absorvido pela massa de gelo para fusão, do calor absorvido pela massa de água resultado da fusão para aquecer de 0°C a 10°C, do calor cedido pelos 150 ml de água a 20°C e do calor cedido pelo calorímetro é dada por:
Q_{fusão} + Q_{água_1} + Q_{água_2} + Q_{calorímetro} = 0
Logo,
m_{gelo} cdot L_{gelo} + m_{gelo} cdot c_{água} cdot Delta theta_1 + m_{água} cdot c_{água} cdot Delta theta_2 + Q_{calorímetro} = 0
Sendo C a capacidade térmica do calorímetro, temos que:
m_{gelo} cdot L_{gelo} + m_{gelo} cdot c_{água} cdot Delta theta_1 + m_{água} cdot c_{água} cdot Delta theta_2 + C Delta theta_C = 0
Como a temperatura final é de 10°C, temos que:
20 cdot 80 + 20 cdot 1 cdot left( 10 - 0 right) + 150 cdot 1 cdot left( 10 - 20 right) + C cdot left( 10 - 20 right) = 0
1600 + 200 - 1500 - 10 C = 0
C = 30 , cal/°C
Dessa forma, haverá 170 g de água a 10°C no interior do calorímetro. Repetindo o raciocínio anterior, após introduzir o sólido, temos que:
Q_{sólido} + Q_{água} + Q_{calorímetro} = 0
Logo,
m_{sólido} cdot c_{sólido} cdot Delta theta_{sólido} + m_{água} cdot c_{água} cdot Delta theta_2 + C cdot Delta theta_{calorímetro} = 0
Como a temperatura final é de 30°C, temos que:
300 cdot c_{sólido} cdot left( 30 - 90 right) + 170 cdot 1,0 cdot left( 30 - 10 right) + 30 cdot left( 30 - 10 right) = 0
-18000 c_{sólido} + 3400 + 600 = 0
c_{sólido} = 0,22 , cal/g°C
Portanto, a resposta correta é a alternativa (D).
1369) Considere que em um experimento realizado em um laboratório de ciências, um estudante utiliza duas peças distintas metálicas, uma de alumínio e outra de ferro. Ele percebe que, ao fornecer a mesma quantidade de calor para ambas as peças, elas apresentam a mesma variação de temperatura.
- A) todos os metais possuem a mesma variação de temperatura ao receberem a mesma quantidade de calor.
- B) as peças metálicas analisadas possuíam mesmo volume e, portanto, tiveram a mesma variação de temperatura ao receberem a mesma quantidade de calor.
- C) as peças metálicas possuíam mesmo calor específico, por isso tiveram a mesma variação de temperatura ao receberem a mesma quantidade de calor.
- D) as peças metálicas possuíam diferentes massas, por isso tiveram a mesma variação de temperatura mesmo sendo de materiais diferentes.
A alternativa correta é letra D) as peças metálicas possuíam diferentes massas, por isso tiveram a mesma variação de temperatura mesmo sendo de materiais diferentes.
A quantidade de calor que um corpo recebe ou cede devido apenas à variação de temperatura é chamada de calor sensível. Podemos determinar essa quantidade de calor utilizando-se a seguinte expressão:
Q = m c Delta theta
Onde m é a massa, c é o calor específico e Delta theta é a variação de temperatura. De acordo com o enunciado, ambas as peças receberam a mesma quantidade de calor e apresentaram a mesma variação da temperatura. Então, temos que:
Q_{Fe} = Q_{Al}
m_{Fe} cdot c_{Fe} cdot cancel { Delta theta } = m_{Al} cdot c_{Al} cdot cancel { Delta theta }
m_{Fe} cdot c_{Fe} = m_{Al} cdot c_{Al}
Então,
m_{Fe} = dfrac { c_{Al} } { c_{Fe} } cdot m_{Al}
Como o calor específico depende do material, sendo que o calor específico do ferro é diferente do alumínio, da equação acima podemos afirmar que as peças metálicaspossuem massas diferentes.
Portanto, a resposta correta é a alternativa (D).
1370) Na Física, estuda-se o calor gerado pela corrente elétrica que atravessa um condutor. Dessa forma, pode-se relacionar intensidade da corrente elétrica (i) que atravessa um condutor de resistência elétrica (R) com o calor dissipado (Q) em um certo intervalo de tempo (Delta t) através da seguinte equação:
- A) a Lei de Ampère.
- B) o efeito Joule.
- C) a Segunda lei da termodinâmica.
- D) o Princípio de Pascal.
A alternativa correta é letra B) o efeito Joule.
A relação entre a corrente elétrica que atravessa um condutor e o calor gerado é dada pela Lei de Joule, um fenômeno descoberto pelo físico britânico James Prescott Joule. A produção de calor é resultante da colisão dos elétrons da corrente elétrica com os átomos do condutor, o que aumenta o grau de agitação desses átomos, elevando a temperatura do condutor. Com isso, temos que a alternativa correta é a letra (b). Entretanto, vamos analisar cada uma das outras alternativas:
a) a Lei de Ampère. INCORRETA.
A lei de Ampère estabelece a relação entre a corrente elétrica e o campo magnético gerado por ela. Alternativa incorreta.
c) a Segunda lei da termodinâmica. INCORRETA.
A segunda lei da termodinâmica estabelece que a entropia de um sistema isolado sempre aumenta em processos irreversíveis, sendo que a entropia é uma parcela de energia do sistema que não pode ser mais convertida em trabalho. Alternativa incorreta.
d) o Princípio de Pascal. INCORRETA.
O princípio de Pascal afirma que, ao exercermos pressão em um fluido confinado, a variação de pressão é transmitida integralmente a todos os pontos de um recipiente. Alternativa incorreta.
Portanto, a resposta correta é a alternativa (B).
