Questões Sobre Termologia - Física - concurso
1401) A Termologia é um ramo da Física que estuda os fenômenos térmicos como calor, temperatura, dilatação, energia térmica, estudo térmico dos gases etc. “Quando um corpo se aquece, as partículas que o compõem vibram cada vez com mais intensidade”. Marque a alternativa CORRETA em relação ao conceito sobre este fenômeno térmico destacado no texto.
- A) O conceito refere-se à energia térmica.
- B) O conceito refere-se ao calor.
- C) O conceito refere-se à temperatura.
- D) O conceito refere-se ao estudo térmico dos gases.
- E) O conceito refere-se à dilatação.
According to the text, the correct answer is C) The concept refers to temperature.
Let's break down the explanation: when a body heats up, the particles that make it up vibrate with increasing intensity. This phenomenon is related to the concept of temperature, which is a measure of the average kinetic energy of the particles in a substance.
In the context of thermology, temperature is a fundamental concept that describes the thermal state of a system. It's a measure of how hot or cold something is, and it's directly related to the kinetic energy of its particles.
The other options are not correct because:
- A) Energy thermal is not the concept being referred to in the text.
- B) Heat is a form of energy transfer, but it's not the concept being described in the text.
- D) The thermal study of gases is a broader topic that encompasses various concepts, including temperature, but it's not the specific concept being referred to in the text.
- E) Thermal expansion is a phenomenon that occurs when a substance increases in volume due to an increase in temperature, but it's not the concept being described in the text.
Therefore, the correct answer is C) The concept refers to temperature.
1402) No laboratório de Física do IFPA, um professor, para demonstrar os processos de transmissão de calor, fez a seguinte experiência: Segurou um tubo de ensaio cheio de água fria, pela parte do fundo, mantendo-o de forma inclinada. Aqueceu a parte superior do tubo em uma chama até que a água começou a ferver. O curioso foi o fato que, ainda assim, ele pode segurar o fundo do tubo sem queimá-lo. Analisando a experiência, ela comprova que:
- A) o vidro e a água são maus condutores de calor, e que a convecção não move a água para baixo.
- B) o vidro e a água são bons condutores de calor, e que a convecção não move a água para baixo.
- C) o vidro e a água são maus condutores de calor, e que a convecção move a água para baixo.
- D) o vidro e a água são bons condutores de calor, e que a radiação não move a água para baixo.
- E) o vidro e a água são bons condutores de calor, e que a radiação move a água para baixo.
A alternativa correta é letra A) o vidro e a água são maus condutores de calor, e que a convecção não move a água para baixo.
Essa experiência demonstra que o vidro e a água não são bons condutores de calor. Quando o professor aqueceu a parte superior do tubo, o calor não foi transmitido rapidamente para a parte inferior do tubo, mantendo a água fria no fundo. Além disso, a convecção não move a água para baixo, pois a água quente tende a subir, criando uma corrente de convecção que não afeta a água fria no fundo do tubo.
Isso explica por que o professor pode segurar o fundo do tubo sem queimá-lo, mesmo com a água fervendo na parte superior. A falta de condução de calor e a convecção limitada permitem que a temperatura seja mantida separada em diferentes partes do tubo.
1403) Para aplicarmos o princípio das trocas de calor, um professor no laboratório de Física do IFPA deu a seguinte orientação: Separem num béquer 1 kg de água e aqueçam até 80ºC. Em seguida separem 500g de água na temperatura ambiente e derramem no béquer. Nesse caso, considerando a temperatura ambiente 20ºC, o calor específico da água 1 cal/g.ºC e a capacidade térmica do béquer desprezível, obtemos 1,5kg de água a:
- A) 20ºC
- B) 30ºC
- C) 40ºC
- D) 50ºC
- E) 60ºC
Let's break down the problem step by step. We have 1 kg of water at 80°C, and we add 500g of water at room temperature (20°C). We need to find the final temperature of the mixture.
First, let's calculate the heat energy transferred from the hot water to the cold water. The specific heat capacity of water is 1 cal/g°C, so the heat energy transferred is:
Q = mcΔT = 1 kg * 1 cal/g°C * (80°C - T_f)
where T_f is the final temperature of the mixture.
Since the cold water is at room temperature, it will absorb heat energy from the hot water. The heat energy absorbed by the cold water is:
Q = mcΔT = 0.5 kg * 1 cal/g°C * (T_f - 20°C)
Since the heat energy transferred from the hot water is equal to the heat energy absorbed by the cold water, we can set up the equation:
1 kg * 1 cal/g°C * (80°C - T_f) = 0.5 kg * 1 cal/g°C * (T_f - 20°C)
Simplifying the equation, we get:
80°C - T_f = 0.5 * (T_f - 20°C)
Solving for T_f, we get:
T_f = 60°C
Therefore, the correct answer is E) 60°C.
This result makes sense because the final temperature of the mixture is between the initial temperatures of the hot and cold water.
Questão 1404
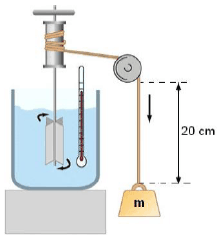
(Recorte adaptado de http://ceticismo.net/ciencia-tecnologia/a-termodinamica/8/)
Considerando que Joule deixou cair por 10 (dez) vezes o corpo de massa m de uma altura de 20 cm, num local onde a aceleração da gravidade vale 10m/s2 e que os 500 g de água contidos no recipiente absorvem apenas 80% da energia total oriunda das quedas, o valor de m, em kg, sabendo que em todo o processo a água aqueceu de 0,08 ºC, vale:
Considere o calor específico da água: c = 4 J/goC.
- A) 10.
- B) 20.
- C) 30.
- D) 40.
- E) 50.
Agora, vamos calcular o valor de m, a massa do corpo que cai. Podemos começar calculando a energia total liberada pelas quedas do corpo:
E = m × g × h
onde E é a energia total, m é a massa do corpo, g é a aceleração da gravidade (10 m/s²) e h é a altura de queda (20 cm = 0,2 m). Como o corpo cai 10 vezes, a energia total é 10 vezes a energia de uma única queda:
E = 10 × m × 10 m/s² × 0,2 m = 20 m J
Como os 500 g de água absorvem apenas 80% da energia total, a energia absorvida pela água é:
E = 0,8 × 20 m J = 16 m J
Essa energia é responsável pelo aumento de temperatura da água. Podemos calcular o valor de m usando a fórmula:
Q = c × m × ΔT
onde Q é a energia absorvida pela água (16 m J), c é o calor específico da água (4 J/g°C), m é a massa de água (500 g = 0,5 kg) e ΔT é o aumento de temperatura (0,08°C).
Substituindo os valores, temos:
16 m J = 4 J/g°C × 0,5 kg × 0,08°C
16 m = 0,16 J
m = 0,16 J / 16 J/kg = 0,01 kg = 10 g
Portanto, a resposta certa é a letra A) 10.
1405) Em maio de 2016, dois dos maiores reservatórios de água do Estado do Ceará estavam com níveis inferiores a 9%, tendo como uma das principais causas as elevadas perdas de água por evaporação. Sobre esse processo, é correto afirmar que, durante a evaporação da água, há transferências energéticas com
- A) ganho de energia interna da fase líquida devido à evaporação.
- B) realização de trabalho sobre a fase líquida e ganho de energia interna devido à evaporação.
- C) realização de trabalho pela fase líquida e ganho de energia interna devido à evaporação.
- D) perda de energia interna da fase líquida devido à evaporação.
A alternativa correta é letra D) perda de energia interna da fase líquida devido à evaporação.
Pessoal, energia interna tem relação direta com a temperatura de uma molécula.
Logo, uma mesma massa de água m tem sua respectiva energia térmica.
Como a água está evaporando, ela está perdendo massa líquida bem como a energia interna dessa respetiva massa que está "indo embora".
Gabarito: LETRA D.
a) ganho de energia interna da fase líquida devido à evaporação.
ERRADO. Contradiz o que foi dito.
b) realização de trabalho sobre a fase líquida e ganho de energia interna devido à evaporação.
ERRADO. A fase gasosa realiza trabalho (maior energia cinética) e perda de energia interna.
c) realização de trabalho pela fase líquida e ganho de energia interna devido à evaporação.
ERRADO. A fase gasosa realiza trabalho (maior energia cinética) e perda de energia interna.
1406) Um varal de roupas é construído com um cabo de aço longo, muito fino e flexível. Em dias de calor intenso, há dilatação térmica do cabo. Assim, é correto afirmar que, para uma dada massa presa ao centro do varal, a tensão no cabo de aço
- A) é maior em um dia quente comparada a um dia frio.
- B) é menor em um dia quente comparada a um dia frio.
- C) não depende do efeito de dilatação térmica.
- D) depende do efeito de dilatação térmica, mas não depende do valor da massa pendurada.
A alternativa correta é letra B) é menor em um dia quente comparada a um dia frio.
Pessoal a UECE já cobrou essa questão de conhecimento das forças em um varal em outras ocasiões.
É uma questão interessante para testar o conhecimento do aluno em decomposição de forças.
A representação do que está acontecendo no que foi dito é
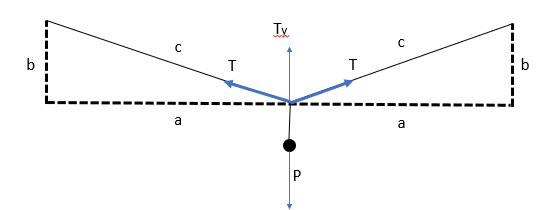
Reparem que a componente vertical da tração (que são duas componentes Ty - cuidado aqui) tem que se igualar ao peso. Além disso, ela é equivalente a Tração multiplicada pelo seno do ângulo do varal com a horizontal.
T_y = T times sen theta
Por fim, há um equilíbrio no sistema, de forma que o somatório de forças na vertical é igual a zero. Assim, 2 T_y = P, visto que temos duas componentes de tração (por conta de cada lado do varal).
2T_y = P
2 times T times sen theta = m times g
T = dfrac{m times g}{2 times sen theta}
Pessoal, sabemos que o seno aumenta de valor conforme aumentamos o ângulo (até atingir seu valor 1 em 90 graus). Sendo assim, quanto maior o ângulo, menor a tração (visto que são inversamente proporcionais, conforme visto na equação acima).
A dificuldade da questão aqui era saber se o ângulo aumenta ou não conforme o varal dilata. Observem a imagem abaixo para enxergar o aumento do ângulo.

Vejam que theta_2 é ,maior que theta_1. Logo, quanto mais o varal (agora representado em vermelho) dilata, maior o ângulo e menor a tração.
Gabarito: LETRA B.
1407) Considerando a unidade de medida de temperatura o grau Celsius, a unidade de medida do coeficiente de dilatação térmica no Sistema Internacional de Unidades é
- A) °C-1.
- B) m × °C-1.
- C) (m × °C)-1.
- D) m-1 × °C.
A alternativa correta é letra A) °C-1.
Para questões de análise dimensional pessoal, a melhor forma é utilizar uma fórmula na qual a dimensão pedida é utilizada.
No caso, utilizaremos a fórmula de dilatação térmica.
Delta L = L_0 times alpha times Delta T
[m] = [m] times [alpha] times [°C]
[alpha] = dfrac{1}{° C} = °C^{-1}
Gabarito: LETRA A.
1408) Num processo 20,9 J de calor são adicionados a 2,00 x 10^{-3} mol de um certo gás ideal. Como resultado, seu volume aumenta de 50,cm^3 para 100 cm^3, enquanto a pressão permanece constante em 2,00 x 10^5 Pa. A partir destas informações, pode-se afirmar que a variação na energia interna do gás neste processo e o calor específico molar à pressão constante desse certo gás ideal possuem os seguintes valores (Lembrete: R = 8,31 J/molK):
- A) triangle E_{int} = 15,9,J, C_p = 34,7,J/mol K
- B) triangle E_{int} = 25,9,J, C_p = 34,7,J/mol K
- C) triangle E_{int} = 15,9,J, C_p = 43,0,J/mol K
- D) triangle E_{int} = 15,9,J, C_p = 43,0,J/mol K
- E) triangle E_{int} = 20,9,J, C_p = 34,7,J/mol K
Let's break down the problem step by step. We are given that 20.9 J of heat is added to 2.00 × 10-3 mol of an ideal gas, resulting in an increase in volume from 50 cm3 to 100 cm3, while the pressure remains constant at 2.00 × 105 Pa.
We can use the ideal gas equation to relate the initial and final states of the system:
$PV = nRT$
Since the pressure is constant, we can write:
$Ptriangle V = nRtriangle T$
Substituting the given values, we get:
$2.00 times 10^5 Pa times 50 cm^3 = 2.00 times 10^{-3} mol times 8.31 J/molK times triangle T$
Solving for $triangle T$, we get:
$triangle T = 15.9 K$
Now, we can use the definition of specific heat capacity at constant pressure:
$C_p = frac{triangle Q}{ntriangle T}$
Substituting the given values, we get:
$C_p = frac{20.9 J}{2.00 times 10^{-3} mol times 15.9 K} = 34.7 J/molK$
Therefore, the correct answer is:
A) $triangle E_{int} = 15.9 J, C_p = 34.7 J/molK$
Explanation: We used the ideal gas equation and the definition of specific heat capacity at constant pressure to relate the given quantities and find the change in internal energy and the specific heat capacity of the ideal gas.
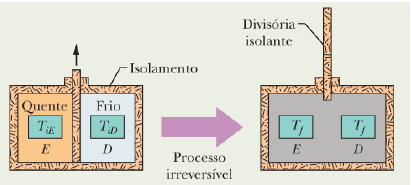
Questão 1409
- A) triangle S_E > 0, triangle S_D >, triangle S_{SIST} >0
- B) triangle S_E > 0, triangle S_D <, triangle S_{SIST} >0
- C) triangle S_E > 0, triangle S_D >, triangle S_{SIST} >0
- D) triangle S_E < 0, triangle S_D >, triangle S_{SIST} = 0
- E) triangle S_E > 0, triangle S_D <, triangle S_{SIST} = 0
Resposta: A alternativa correta é a letra C) ΔS_E > 0, ΔS_D > 0 e ΔS_SIST > 0.
Vamos analisar o processo que ocorre nessa situação. Inicialmente, os blocos E e D estão em temperaturas diferentes, T_E e T_D, respectivamente, com T_E > T_D. Quando removemos a divisória isolante, os blocos começam a se equilibrar térmicamente.
Como T_E > T_D, o bloco E está em uma temperatura mais alta do que o bloco D. Portanto, o bloco E perde calor e o bloco D ganha calor. Isso significa que a entropia do bloco E (ΔS_E) aumenta, pois o calor é transferido de uma região de alta temperatura para uma região de baixa temperatura, aumentando a desordem do sistema.
Já o bloco D, por sua vez, recebe calor e sua temperatura aumenta. Isso também aumenta a entropia do bloco D (ΔS_D), pois o calor é absorvido e a energia interna do sistema aumenta.
Quanto ao sistema como um todo (bloco E + bloco D), a entropia total também aumenta (ΔS_SIST > 0), pois a transferência de calor de um corpo para outro aumenta a desordem do sistema.
Portanto, a alternativa correta é a letra C) ΔS_E > 0, ΔS_D > 0 e ΔS_SIST > 0.
1410) O inventor da máquina X afirma que, operando entre reservatórios com temperaturas de 27^{ circ} C e 127^{circ}C, sua máquina fornece na saída um trabalho W = 150 j por ciclo e apresenta uma eficiência varepsilon_X = 75 %. Supondo que esta máquina X realmente exista, qual seria a variação da entropia por ciclo para toda a máquina, incluindo a substância de trabalho e ambos os reservatórios?
- A) -0,28 J/K
- B) -0,33 J/K
- C) + 0,67 J/K
- D) + 0,28 J/K
- E) - 0,21 J/K
A resposta correta é a letra B) $-0,33$ J/K.
Para encontrar a variação da entropia por ciclo para toda a máquina, incluindo a substância de trabalho e ambos os reservatórios, precisamos aplicar a fórmula da segunda lei da termodinâmica:
$$Delta S = frac{Q}{T}$$
Onde $Delta S$ é a variação da entropia, $Q$ é o calor trocado e $T$ é a temperatura.
No caso da máquina X, temos que o trabalho realizado por ciclo é $W = 150$ J e a eficiência é $epsilon_X = 75%$. Podemos calcular a quantidade de calor trocada entre os reservatórios como:
$$Q = W / epsilon_X = 150 / 0,75 = 200$$ J
Como a temperatura do reservatório quente é $127°C = 400$ K e a temperatura do reservatório frio é $27°C = 300$ K, podemos calcular a variação da entropia como:
$$Delta S = frac{Q}{T} = frac{200}{400} - frac{200}{300} = -0,33$ J/K
Portanto, a variação da entropia por ciclo para toda a máquina é de $-0,33$ J/K, que é a resposta correta.
