Questões Sobre Termologia - Física - concurso
Questão 1431
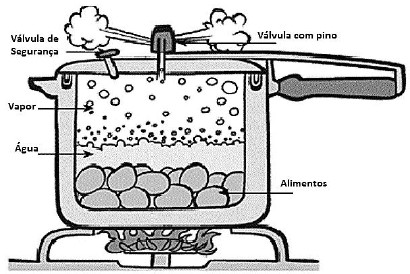
http://www.if.ufrgs.br/cref/?area=questions&id=46.
Para esse cozimento acontecer de forma mais rápida do que o cozimento em outros tipos de panelas, pode-se afirmar que
- A) a pressão sobre o líquido permanece inalterada.
- B) a pressão exercida na parede da panela de pressão permanece inalterada.
- C) o aumento da pressão comprime os vapores existentes na panela.
- D) a temperatura de ebulição da água permanece em 100°C.
- E) o aumento de pressão faz aumentar a temperatura de ebulição da água.
A alternativa correta é letra E) o aumento de pressão faz aumentar a temperatura de ebulição da água.
Analisando uma a uma
a) a pressão sobre o líquido permanece inalterada. ERRADA. Completamente contraditória. A pressão aumenta conforme sugere o próprio nome da panela.
b) a pressão exercida na parede da panela de pressão permanece inalterada. ERRADA. Ela aumenta. No passado, não era difícil acidentes envolvendo panelas por conta de erros de manuseio que levavam a "explosão" da panela.
c) o aumento da pressão comprime os vapores existentes na panela. ERRADA. Muitos candidatos podem ter marcado essa e errado. A pressão realmente comprime os vapores, porém não é esse fator que aumenta o cozimento.
d) a temperatura de ebulição da água permanece em 100°C.
ERRADA. Quanto maior a pressão, maior a temperatura de ebulição.
e) o aumento de pressão faz aumentar a temperatura de ebulição da água. CORRETA. Conforme explicação acima. Com a temperatura de ebulição maior, os alimentos ficam na água que está a uma temperatura mais levada antes de vaporizar.
Gabarito: LETRA E.
1432) A uma determinada temperatura um pino ajusta-se exatamente em um orifício de uma placa metálica. Para que o pino passe com folga pelo orifício da placa metálica, deve-se considerar que
- A) o pino deve ser aquecido.
- B) a chapa deve ser aquecida.
- C) o pino deve sofrer dilatação.
- D) a chapa deve sofrer compressão.
- E) a chapa e o pino devem ser aquecidos.
A alternativa correta é letra B) a chapa deve ser aquecida.
Pessoal, os materiais tendem a se dilatar com aumento de temperaturas (especialmente os metálicos).
Analisando uma a uma
a) o pino deve ser aquecido.
ERRADA. Com isso, o pino aumentaria e apertaria ainda mais o ajuste.
b) a chapa deve ser aquecida.
CORRETA. Com a chapa dilatando, o pino ficaria mais folgado.
c) o pino deve sofrer dilatação.
ERRADA. Similar a explicação da A. Ao sofrer dilatação, o aperto ficaria mais justo.
d) a chapa deve sofrer compressão.
ERRADA. Isso iria apertar o conjunto todo pressionando ainda mais o pino.
e) a chapa e o pino devem ser aquecidos.
ERRADA. Se forem de materiais diferentes e a chapa ter coeficiente de dilatação maior essa poderia ser o gabarito. Entretanto, a questão nada mencionou sobre o coeficiente de cada material.
Gabarito: LETRA B.
1433) Duas barras, uma de zinco (αZn = 3,0.10-5 oC-1) e outra de ferro (αFe = 1,2.10-5 oC-1), têm comprimentos iguais a 0 oC. A 100 oC, seus comprimentos diferem de 1,8 mm. Qual é o comprimento das barras a 0 oC?
- A) 0,5 m
- B) 0,9 m
- C) 1,0 m
- D) 2,0 m
Resposta: A alternativa correta é a letra C) 1,0 m
Vamos analisar a questão passo a passo. Temos duas barras, uma de zinco e outra de ferro, com comprimentos iguais a 0°C. A 100°C, seus comprimentos diferem de 1,8 mm.
Para resolver essa questão, precisamos utilizar a fórmula de dilatação térmica linear, que é dada por:
$$Delta L = alpha cdot L_0 cdot Delta T$$
Onde:
- $Delta L$ é a variação do comprimento da barra;
- $alpha$ é o coeficiente de dilatação térmica linear;
- $L_0$ é o comprimento inicial da barra;
- $Delta T$ é a variação de temperatura.
No nosso caso, temos duas barras com comprimentos iguais a 0°C, então $L_0$ é o mesmo para as duas barras. Além disso, a variação de temperatura é a mesma para as duas barras, ou seja, $Delta T = 100°C - 0°C = 100°C$.
A diferença entre os comprimentos das barras a 100°C é de 1,8 mm, então podemos escrever:
$$Delta L_{Zn} - Delta L_{Fe} = 1,8 mm$$
Substituindo a fórmula de dilatação térmica linear, obtemos:
$$alpha_{Zn} cdot L_0 cdot Delta T - alpha_{Fe} cdot L_0 cdot Delta T = 1,8 mm$$
Simplificando a equação, obtemos:
$$(alpha_{Zn} - alpha_{Fe}) cdot L_0 cdot Delta T = 1,8 mm$$
Agora, podemos substituir os valores dados na questão:
$$(3,0 cdot 10^{-5} circ C^{-1} - 1,2 cdot 10^{-5} circ C^{-1}) cdot L_0 cdot 100°C = 1,8 mm$$
Simplificando a equação, obtemos:
$$1,8 cdot 10^{-5} circ C^{-1} cdot L_0 = 1,8 mm$$
Finalmente, podemos calcular o comprimento inicial das barras:
$$L_0 = frac{1,8 mm}{1,8 cdot 10^{-5} circ C^{-1} cdot 100°C} = 1,0 m$$
Portanto, a alternativa correta é a letra C) 1,0 m.
1434) Uma pedra de gelo a 0°C de massa desconhecida foi colocada em um recipiente contendo 100 g de água a 24°C. Considerando que não houve troca de calor com o meio externo e que ao atingir o equilíbrio térmico ainda restaram 40 g de gelo, então a massa de gelo colocada inicialmente no recipiente era de:
- A) 60 g.
- B) 70 g.
- C) 80 g.
- D) 90 g.
A alternativa correta é letra B) 70 g.
Calor cedido pela água
Temos 1 caloria para cada grama-grau Celsius.
No total, foram 100 gramas variando 24 ºC. Isso dá:
100 times 24 = 2.400 mbox g ^ circ mbox C
Como o calor específico é de 1 caloria para cada g ºC, concluímos que a água cede para o gelo 2.400 calorias.
Massa de gelo derretida
Cada 80 calorias conseguem derreter 1 grama de gelo.
Como dispomos de 2.400 calorias, ficamos com:
80 calorias .... 1 grama de gelo
2.400 calorias .... x gramas de gelo
80x = 2.400
x=30
Foram derretidos 30 gramas de gelo.
Massa inicial de gelo
Já vimos que 30 gramas de gelo foram derretidas. Somando com os 40 gramas que sobraram, concluímos que a pedra tinha inicialmente 30+40=70 gramas.
Resposta: B
1435) Quando 2,5 kg de uma substância A, cujo calor específico é 0,8 cal/g°C a 1,5°C é misturada com x kg, dessa mesma substância, a 30°C, obtém-se uma mistura com temperatura igual a 15°C. Considerando que a substância não passa por nenhuma mudança de estado, então a massa total dessa mistura é:
- A) 4,75 Kg.
- B) 5 Kg.
- C) 5,25 Kg.
- D) 5,5 Kg.
A alternativa correta é letra A) 4,75 Kg.
Sabemos que o calor específico é a quantidade de calor necessária para que cada grama de uma substância sofra uma variação de temperatura correspondente a 1°C. Essa grandeza nos mostra o comportamento do material quando exposto a uma fonte de calor. Quando a mistura foi feita, os x kg da substância A a 30 °C forneceram calor suficiente para aquecer 2,5 kg da mesma substância A de 1,5 °C até 15°C. Podemos calcular essa quantidade de calor da seguinte maneira:
Q = m cdot c cdot Delta theta
Q = 2,5 cdot 0,8 cdot left( 15 - 1,5 right)
Q = 27 cal
Como a fonte desse calor foram os x kg da mesma substância que esfriaram de 30°C até 15°C, podemos escrever:
Q = m cdot c cdot Delta theta
-27 = x cdot 0,8 cdot left( 15 - 30 right)
-27 = x cdot left( -12 right)
x = 2,25 kg
Portanto, a massa total da mistura é 2,5 + 2,25 = 4,75 kg. O gabarito da questão é a alternativa (a).
1436) Um gás se encontra em um recipiente fechado que possui uma tampa móvel. Ao ser submetido a uma chama, o gás recebe 450J de calor e, consequentemente, desloca a tampa em 15 cm. A força exercida pelo gás na tampa tem módulo igual a:
- A) 30 N.
- B) 67,5 N.
- C) 3.000 N.
- D) 6.750 N.
A alternativa correta é letra C) 3.000 N.
Nesse processo termodinâmico, a lei de conservação da energia assume a forma da primeira lei da termodinâmica dada pela seguinte equação:
Delta E_{int} = Q-W
Onde,
E_{int} é a energia interna do material
Q é a energia trocada com o ambiente, na forma de calor; Q é positivo, se o sistema absorve calor, e negativo, se o sistema cede calor
W é a energia trocada com o ambiente na forma de trabalho; W é positivo, se o sistema realiza trabalho sobre o ambiente, e negativo, se o ambiente realiza trabalho sobre o sistema.
Em alguns casos especiais, temos as seguinte aplicações da primeira lei da termodinâmica:
- processos adiabáticos: Q = 0, Delta E_{int} = –W
- processos a volume constante: W = 0, Delta E_{int} = Q
- processos cíclicos: Delta E_{int} = 0, Q = W
- expansões livres: Q = W, Delta E_{int} = 0
No caso do enunciado, temos uma expansão livre, na qual o calor transferido ao gás se transforma em trabalho, movendo a tampa. Logo,
Delta E_{int} = Q-W
0 = 450 - W
W = 450 J
Lembrando que trabalho é o produto entre a força e o deslocamento (tau = F cdot Delta S), temos
tau = W
F cdot Delta S = 450
F cdot 0,15 = 450
F = 3.000 N
Portanto, a alternativa correta é a letra (c).
1437) Um cubo de ferro, de volume v = 6 litros e temperatura to = 280°C, foi colocado em um ambiente com temperatura t. Após ter resfriado, constatou-se uma diminuição de 55,08 cm³ no volume do cubo. A temperatura t do ambiente é:
- A) 20°C.
- B) 25°C.
- C) 30°C.
- D) 35°C.
A alternativa correta é letra B) 25°C.
Podemos calcular a dilatação volumétrica utilizando a seguinte equação:
Delta V = V_0 cdot gamma cdot Delta theta
Onde,
Delta V é a variação do volume
V_0 é o volume inicial
gamma é o coeficiente de dilatação volumétrica
Delta theta é a variação de temperatura
Lembrando que o coeficiente de dilatação volumétrica é dado por gamma = 3 alpha. Como 1 L = 1000 cm^3, temos
Delta V = V_0 cdot gamma cdot Delta theta
55,08 = 6 cdot 1000 cdot ( 3 cdot 1,2 . 10 ^{-5}) cdot Delta theta
Delta theta = 255 ^circ C
Assim, a temperatura do ambiente pode ser calculada como:
Delta theta = 280 - t
255 = 280 - t
t = 25 ^circ C
Portanto, a alternativa correta é a letra (b).
1438) Um recipiente de vidro com capacidade de 1000 ml está completamente cheio com um certo líquido, sendo que o coeficiente de dilatação linear do vidro é 2 . 10–5 °C–1 e o coeficiente de dilatação volumétrica do líquido é de 1,8 . 10–4 °C–1. Qual deve ser o aumento da temperatura do conjunto recipiente mais líquido para que 9 ml do líquido extravase?
- A) 68°C.
- B) 75°C.
- C) 84°C.
- D) 92°C.
A alternativa correta é letra B) 75°C.
Com o aumento da temperatura do conjunto recipiente mais líquido, há uma dilatação volumétrica tanto do líquido, quanto do recipiente. Assim, a dilatação do líquido será igual à soma da dilatação volumétrica do recipiente mais o volume extravasado. Lembrando que:
Delta V = V_0 cdot gamma cdot Delta theta
Onde,
Delta V é a variação volumétrica
V_0 é o volume inicial
gamma é o coeficiente de dilatação volumétrica dado por gamma = 3 alpha.
Delta theta é a variação de temperatura
Assim, temos:
Delta V_{líquido} = Delta V_{extravasado} + Delta V_{recipiente}
1000 cdot 1,8 . 10^{–4} cdot Delta theta = 9 + 1000 cdot left( 3 cdot 2 . 10^{–5} right) cdot Delta theta
0,18 Delta theta = 9 + 0,06 Delta theta
left( 0,18 - 0,06 right) Delta theta = 9
Delta theta = 75^circ C
Portanto, a alternativa correta é a letra (b).
1439) Uma das formas de se obter energia térmica é através da combustão ou queima de materiais. Cada substância na sua queima libera uma quantidade de calor diferente. A quantidade de calor que cada substância libera na combustão é chamada calor de combustão. Considere que um fogareiro com um botijão de gás permite aquecer no máximo 225 litros de água de 20°C até 100°C e que o calor de combustão do gás é de 6000 kcal/kg. Sendo assim, esse é um botijão de:
- A) 2 kg.
- B) 3 kg.
- C) 4 kg.
- D) 5 kg.
A alternativa correta é letra B) 3 kg.
Vamos calcular a quantidade de calor para aquecer 225 litros de água de 20ºC até 10ºC. Para tanto, vamos utilizar a seguinte equação:
Q = m cdot c cdot Delta theta
Lembrando que o calor específico da água é 1,0 cal/gºC e que 225 litros de água equivalem a 225.000 g de água. Logo,
Q = 225.000 cdot 1,0 cdot (100 - 20)
Q = 18.000 kcal
Se 1 kg do gás fornecem 6.000 kcal, precisamos dividir as 18.000 kcal necessárias para aquecer a água pelo calor de combustão do gás. Assim,
m = dfrac {18.000 kcal} {6.000 kcal/kg}
m = 3 kg
Portanto, o gabarito da questão é a alternativa (b), 3 kg.
1440) Uma escala termométrica X apresenta para o ponto de fusão 20° X e uma variação qualquer de temperatura nessa escala corresponde à metade da variação de temperatura sofrida na escala Fahrenheit. A relação correta entre essas duas escalas é:
- A)
X = frac {F} {2} + 4.
- B)
X = frac {F} {4} -2.
- C)
X = frac {F} {2} -4.
- D)
X = frac {F} {4} +2.
A alternativa correta é letra A)
X = frac {F} {2} + 4.
Para encontrar a relação correta entre duas escalas, é preciso conhecer pelo menos 2 pontos em comum. Ainda, precisamos lembrar que o ponto de fusão da água na escala Fahrenheit é 32 °F e que o ponto de ebulição da água é 212 ºF. Como a variação entre o ponto de fusão e ebulição da água na escala Fahrenheit é de 212 - 32 = 180 ºF, podemos concluir que essa mesma variação é de 90 °X, de acordo com o enunciado (metade da variação de temperatura na escala Fahrenheit). Logo, podemos considerar o seguinte esquema:
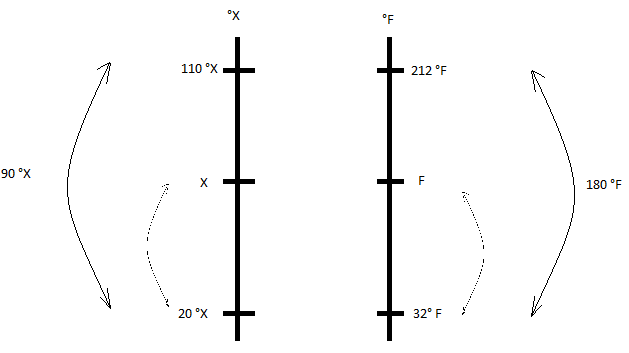
Assim, podemos estabelecer uma relação de proporção entre os segmentos das escalas em X e F. Logo,
dfrac {X - 20} {110 - 20} = dfrac {F-32} {212-32}
dfrac {X - 20} {90} = dfrac {F-32} {180}
X - 20 = dfrac {F-32} {2}
2X - 2 cdot 20 = F - 32
2X - 40 = F - 32
2X = F + 8
X = dfrac {F} {2} + 4
Portanto, o gabarito da questão é a alternativa (a).
