Questões Sobre Termologia - Física - concurso
Questão 1451
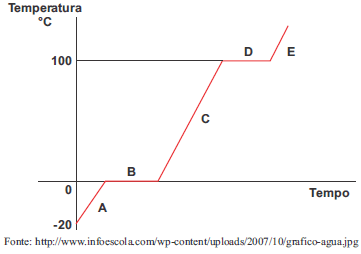
É CORRETO afirmar que a água encontra-se em B e D, respectivamente, nos estados físicos
- A) Sólido/ Líquido e Líquido/Gasoso.
- B) Sólido apenas e Líquido Apenas.
- C) Gasoso/Líquido e Gasoso/Líquido.
- D) Sólido/ Líquido e Líquido apenas.
- E) Líquido apenas e Gasoso apenas.
A alternativa correta é letra A) Sólido/ Líquido e Líquido/Gasoso.
No gráfico, é possível observar que a curva da temperatura apresenta dois tipos de comportamento: um trecho de aumento linear e um trecho de temperatura constante.
Nos trechos de aumento linear, a água se apresenta em apenas um estado físico, no qual o fornecimento de calor é responsável apenas pelo aumento da temperatura. No gráfico, podemos identificar os trechos A, C e E. No trecho A, a água está a uma temperatura abaixo de 0°C, portanto encontra-se no estado sólido. No trecho C, a água está entre 0°C e 100°C, encontrando-se em estado líquido. No trecho E, a água encontra-se acima de 100°C, portanto em estado gasoso.
Nos trechos de temperatura constante, o fornecimento de calor é responsável pela mudança de estado físico, identificados no gráfico como os trechos B e D. No trecho B, a água encontra-se a 0°, portando coexiste nos estados sólido e líquido. No trecho D, a água encontra-se a 100°C, portanto apresenta-se nos estados líquido e gasoso.
Portanto, o gabarito da questão é a alternativa (a).
Questão 1452
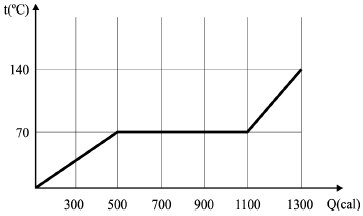
Com referência ao gráfico precedente, julgue o item a seguir.
Durante toda a mudança de fase a substância absorveu 600 cal de calor.
- A) Certo
- B) Errado
A alternativa correta é letra A) Certo
Gabarito: CERTO
CERTO
A mudança de fase de uma substância ocorre a temperatura constante, observado o gráfico, temos que, a temperatura é constante em 70°C e a substância recebe calor de 500cal até 1100cal. Assim, durante toda a mudança de fase a substância absorveu 600 cal de calor.
Questão 1453
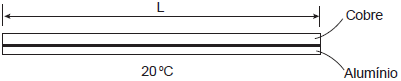
O conjunto é então aquecido até 120 ºC.
Sabendo-se que a 120 ºC a deformação térmica do alumínio é maior que a deformação térmica do cobre, a configuração final do conjunto a 120 ºC apresentará uma deformação axial
- A) igual à do cobre quando aquecido a 120 ºC.
- B) igual à do alumínio quando aquecido a 120 ºC.
- C) inferior à do cobre quando aquecido a 120 ºC.
- D) superior à do alumínio quando aquecido a 120 ºC.
- E) superior à do cobre quando aquecido a 120 ºC.
A alternativa correta é letra E) superior à do cobre quando aquecido a 120 ºC.
Gabarito: LETRA E.
Sabemos que, quando os materiais são aquecidos, ocorre um fenômeno físico chamado de dilatação térmica, no qual um material se expande ou contrai em resposta a variações na temperatura. Esse processo é causado pelo aumento da energia térmica das partículas, que leva a um aumento médio na distância entre elas. Essa variação de comprimento pode ser calculada usando o coeficiente de dilatação térmica do material, que descreve a taxa de variação dimensional em relação à variação na temperatura, através da seguinte equação:
Delta L = L_0 cdot alpha cdot Delta T
Onde L_0 é o comprimento inicial, alpha é o coeficiente de dilatação térmica e Delta T é a variação de temperatura.
O coeficiente de expansão térmica é uma medida da taxa na qual um material se expande ou contrai em resposta a uma mudança na temperatura, de forma que diferentes materiais têm coeficientes de expansão térmica diferentes.
No caso da questão, o alumínio tem um coeficiente de expansão térmica maior do que o cobre. Isso significa que, quando aquecidos à mesma temperatura, o alumínio se expandirá mais do que o cobre. Então, como as barras estão coladas juntas, a expansão térmica maior do alumínio fará com que a configuração final do conjunto seja uma deformação axial superior à do cobre quando aquecido a 120 ºC.
Portanto, a resposta correta é a alternativa (e).
1454) A dilatação térmica dos materiais é um fenômeno que deve ser considerado em diversos projetos de equipamentos e estruturas.
- A) 3,6
- B) 5,4
- C) 7,2
- D) 8,5
- E) 14,4
A alternativa correta é letra C) 7,2
Gabarito: LETRA C.
A dilatação térmica é um fenômeno físico que ocorre quando um material sofre uma variação de temperatura e, como resultado, seu tamanho ou volume se altera. Esse fenômeno deve ser considerado em projetos de equipamentos e estruturas, uma vez que a expansão ou contração térmica dos materiais pode afetar seu desempenho, integridade e funcionamento adequado.
Para calcular a variação de comprimento do cabo de aço devido à variação de temperatura, podemos utilizar a equação da dilatação linear:
Delta L = L_0 cdot alpha cdot Delta T
Onde L_0 é o comprimento inicial, alpha é o coeficiente de dilatação linear e Delta T é a variação de temperatura.
Substituindo os valores do enunciado, temos:
Delta L = 30 cdot 0,00012 cdot 20
Delta L = 0,072 , m
Delta L = 7,2 , cm
Portanto, a resposta correta é a alternativa (c).
1455) A dissolução de uma determinada substância em 5 kg de água a 25ºC resultou numa solução cuja temperatura é de 10ºC.
- A) 75 kcal; endotérmico
- B) 75 kcal; exotérmico
- C) 75 cal; endotérmico
- D) 75 cal; exotérmico
- E) 50 kcal; exotérmico
A alternativa correta é letra A) 75 kcal; endotérmico
Gabarito: LETRA A.
Podemos calcular a quantidade de calor envolvido utilizando a equação:
Q = m c Delta T
Onde m é a massa da substância, c é o calor específico e Delta T é a variação de temperatura.
No caso apresentado, a massa do solvente (água) é de m = 5 , kg = 5000 , g e a variação de temperatura é de Delta T = 25°C - 10°C = 15°C. Substituindo esses valores na equação acima, temos:
Q = 5000 cancel g cdot 1 dfrac { cal } { cancel g cancel {°C} } cdot 15 cancel {°C}
Q = 75000 , cal
Q = 75 , kcal
Ou seja, a quantidade de calor envolvida no processo é de 75 kcal.
Para caracterizar o processo, é importante observar que ocorreu uma diminuição na temperatura da água. Isso significa que a substância dissolvida absorveu calor. Esse tipo de processo, em que há absorção de calor, é chamado de processo endotérmico.
Portanto, a resposta correta é a alternativa (a).
Questão 1456
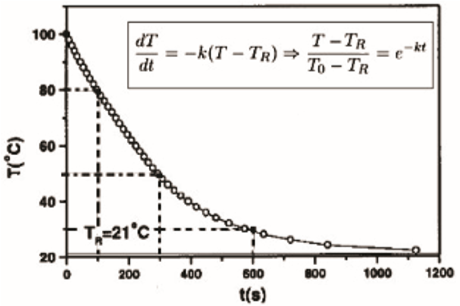
Figura: Evolução da temperatura de uma amostra de 10 cm3 de glicerina. Adaptado de Rev. Brasileira de Ensino de Física, vol. 21, no. 1, 1999, p.116.
Considerando 1/e = 0,37. O valor da constante k para esse experimento é de aproximadamente:
- A) 2 x 10^{-2} 1/s
- B) 5 x 10^{-2} 1/s
- C) 1 x 110^{-3} 1/s
- D) 4 x 10^{-2} 1/s
- E) 3 x 10^{-3} 1/s
A resposta correta é a letra E) 3 x 10^-3 s^-1
O valor da constante k pode ser encontrado a partir da equação da Lei de Resfriamento de Newton, que é dada por:
dT/dt = -k * (T - T_R)
onde T é a temperatura do corpo, T_R é a temperatura do meio ambiente e k é a constante de resfriamento.
A partir do gráfico, podemos observar que a temperatura do corpo diminui exponencialmente com o tempo. Isso ocorre porque a taxa de resfriamento é proporcional à diferença entre a temperatura do corpo e a temperatura do meio ambiente.
Para encontrar o valor de k, podemos rearranjar a equação acima para isolar k:
k = -dT/dt / (T - T_R)
Substituindo os valores dados no problema, temos:
k = -dT/dt / (100°C - 21°C)
Como a taxa de resfriamento é constante, podemos calcular a derivada da temperatura em relação ao tempo a partir do gráfico. Observamos que a temperatura diminui de 100°C para cerca de 40°C em aproximadamente 100 segundos.
Portanto, podemos calcular a derivada da temperatura em relação ao tempo como:
dT/dt ≈ -60°C/100s ≈ -0.6°C/s
Agora, podemos calcular o valor de k:
k = -(-0.6°C/s) / (100°C - 21°C) ≈ 3 x 10^-3 s^-1
Portanto, a resposta correta é a letra E) 3 x 10^-3 s^-1.
1457) Em meados do século XVIII o conceito de calor especifico e de calor latente não estavam ainda formulados, tarefa que foi resolvida entre 1761 e 1772 com trabalhos dos físicos Joseph Black e Johan Carl Wilcke. Por volta de 1749 predominava a expectativa de que a temperatura de equilíbrio térmico sempre estaria na proporção das massas ou dos volumes das substâncias, sem menção à essa característica intrínseca dos materiais.
- A) No equilíbrio térmico ainda haveria 10% da massa inicial de gelo
- B) No equilíbrio térmico ainda haveria 2,5% da massa inicial de gelo
- C) O equilíbrio térmico ocorreria em 39°C
- D) O equilíbrio térmico seria estabelecido a 0,25°C
- E) O equilíbrio térmico seria estabelecido a 10°C
Resposta: A alternativa correta é letra B) No equilíbrio térmico ainda haveria 2,<|begin_of_text|>2,5% da massa inicial de gelo.
Para entender por que essa é a resposta correta, vamos analisar o experimento de Black. Nesse experimento, Black misturou água a 78°C com a mesma quantidade de gelo a 0°C. Após a mistura, observou-se que o gelo se fundiu todo, mantendo-se em 0°C.
Essa experiência nos permite entender que a temperatura de equilíbrio térmico não é simplesmente a proporção das massas ou volumes das substâncias. Em vez disso, é necessário considerar as propriedades térmicas intrínsecas dos materiais.
No caso do experimento de Black, sabemos que a água tem um calor específico de 1 cal/g°C e o gelo tem um calor latente de fusão de 80 cal/g. Isso significa que, para que a temperatura da mistura seja de 0°C, é necessário que o gelo absorva calor da água para se fundir.
Calculando a quantidade de calor necessária para que a água se resfrie de 78°C para 0°C, encontramos que é necessário um calor de aproximadamente 78 cal. Como o gelo tem um calor latente de fusão de 80 cal/g, isso significa que apenas 2,5% da massa inicial de gelo é necessário para absorver todo o calor da água e se fundir.
Portanto, a alternativa correta é letra B) No equilíbrio térmico ainda haveria 2,5% da massa inicial de gelo.
1458) O consumo energético primário da humanidade (energia extraída das fontes entre elas, por exemplo, petróleo, carvão, gás e fontes renováveis) é estimado hoje estar por volta de 500EJ por ano (E, exa, 10^{18}). Por sua vez a energia solar total irradiada anualmente sobre o planeta terra é de cerca de 4×10^6 EJ. Em caráter de comparação de escala, se utilizássemos cada uma dessas duas quantidades anuais de energia separadamente (consumo primário da humanidade e solar) para aquecer idealmente toda a água disponível na Terra, de cerca de 1 x 10^9km^3 (considerando que estivesse em estado líquido com calor específico de 4J/g°C, densidade d=1000kg/m^3), a elevação da temperatura da água seria da ordem de:
- A) 10-1°C (humanidade) e 1°C (Sol)
- B) 10-1°C (humanidade) e 103°C (Sol)
- C) 10-2°C (humanidade) e 10°C (Sol)
- D) 10-3°C (humanidade) e 10°C (Sol)
- E) 10-4°C (humanidade) e 1°C (Sol)
Hey there! Let's dive into the world of thermodynamics and explore the correct answer to this question.
The Correct Answer: E) 10^(-4)°C (humanidade) e 1°C (Sol)
Now, let's break down the explanation step by step.
First, we need to understand the context of the question. We're talking about the primary energy consumption of humanity, which is approximately 500 EJ per year. On the other hand, the total solar energy irradiated on Earth annually is around 4 × 10^6 EJ.
Now, let's assume we use each of these two energy quantities separately to heat up all the available water on Earth, which is approximately 1 × 10^9 km^3 (considering it's in a liquid state with a specific heat capacity of 4 J/g°C and a density of 1000 kg/m^3).
Using the energy consumption of humanity, we can calculate the temperature increase of the water. The formula to use is:
ΔT = Q / (m × c)
where ΔT is the temperature change, Q is the energy, m is the mass of the water, and c is the specific heat capacity.
Plugging in the numbers, we get:
ΔT ≈ 500 EJ / (1 × 10^9 km^3 × 1000 kg/m^3 × 4 J/g°C) ≈ 10^(-4)°C
Now, let's do the same calculation using the total solar energy irradiated on Earth. We get:
ΔT ≈ 4 × 10^6 EJ / (1 × 10^9 km^3 × 1000 kg/m^3 × 4 J/g°C) ≈ 1°C
Therefore, the correct answer is E) 10^(-4)°C (humanidade) e 1°C (Sol).
I hope this explanation helps you understand the concept better!
1459) Durante uma conversa com seus alunos sobre dieta, metabolismo e gasto calórico, uma professora de Biologia escuta o seguinte comentário:
- A) Primeira Lei de Newton
- B) Lei de Stevin
- C) Primeira Lei da Termodinâmica
- D) Lei de Coulomb
A alternativa correta é letra C) Primeira Lei da Termodinâmica
Gabarito: LETRA C.
Vamos analisar cada uma das alternativas:
a) Primeira Lei de Newton
Incorreta. A Primeira Lei de Newton, também conhecida como Lei da Inércia, afirma que um objeto em repouso permanecerá em repouso, e um objeto em movimento continuará em movimento com velocidade constante a menos que uma força externa atue sobre ele. Essa lei se aplica ao movimento de objetos e não está relacionada à questão do ganho ou perda de peso do aluno.
b) Lei de Stevin
Incorreta. A Lei de Stevin, também conhecida como Lei dos Fluidos, descreve como a pressão de um fluido (como um líquido) varia com a profundidade e a densidade do fluido. Ela também não tem relação com o ganho ou perda de peso e o metabolismo humano.
c) Primeira Lei da Termodinâmica
Correta. A Primeira Lei da Termodinâmica, que é uma versão do princípio da conservação de energia para sistemas termodinâmicos, estabelece que a energia não pode ser criada nem destruída, apenas transformada de uma forma para outra (por exemplo, calor para trabalho).
No contexto da nutrição e do ganho ou perda de peso, essa lei implica que qualquer alteração no peso corporal deve estar relacionada a um desequilíbrio entre a energia consumida (através da alimentação) e a energia gasta (através do metabolismo e da atividade física). Isso significa que, se uma pessoa não está ingerindo alimentos e está realizando exercícios físicos, então, de acordo com a Primeira Lei da Termodinâmica, ela não deveria estar ganhando peso.
d) Lei de Coulomb
Incorreta. A Lei de Coulomb descreve as interações eletrostáticas entre partículas carregadas eletricamente. Ela é aplicada à física das cargas elétricas e não está relacionada ao ganho ou perda de peso da aluna.
Portanto, a resposta correta é a alternativa (c)
1460) Dois blocos A e B de materiais distintos possuem massa de, respectivamente, 200 g e 100 g. Para que eles obtenham a mesma variação de temperatura, é necessário fornecer ao bloco A o triplo da quantidade de calor fornecida a B.
- A) o coeficiente de dilatação volumétrico de A é 2,5 vezes maior que o de B.
- B) a capacidade térmica de A é 1,5 vezes maior que a de B.
- C) o calor específico de A é 1,5 vezes maior que o de B.
- D) a massa específica de B é 2,5 vezes maior que a de B.
A alternativa correta é letra C) o calor específico de A é 1,5 vezes maior que o de B.
Gabarito: LETRA C.
O calor responsável pela variação de temperatura de uma substância é chamada de calor sensível, e pode ser calculado utilizando a equação:
Q = m c Delta T tag 1
Onde m é a massa, c é o calor específico e Delta T é a variação de temperatura da substância.
Assim, vamos analisar cada uma das alternativas:
a) o coeficiente de dilatação volumétrico de A é 2,5 vezes maior que o de B.
Incorreta. Essa afirmação não pode ser inferida a partir das informações fornecidas na questão. O coeficiente de dilatação volumétrica não está relacionado diretamente à capacidade térmica ou à variação de temperatura quando calor é fornecido aos materiais.
b) a capacidade térmica de A é 1,5 vezes maior que a de B.
Incorreta. A partir da equação (1), podemos relacionar a capacidade térmica (C) ao calor (Q) fornecido da seguinte maneira:
Q = C cdot Delta T tag 2
Onde C = m c é a capacidade térmica e Delta T é a variação da temperatura da substância. Do enunciado, temos que Q_A = 3 Q_B. Assim, de acordo com a equação (2), podemos escrever:
Q_A = 3 Q_B
C_A Delta T_A = 3 C_B Delta T_B
Porém, para uma mesma variação de temperatura, temos Delta T_A = Delta T_B. Logo,
C_A cancel { Delta T_B} = 3 C_B cancel { Delta T_B}
C_A = 3 C_B tag 3
Ou seja, a capacidade térmica de A é 3 vezes maior que a de B.
c) o calor específico de A é 1,5 vezes maior que o de B.
Correta. De acordo com a equação (3), temos:
C_A = 3 C_B
Logo,
m_A c_A = 3 m_B c_B
Substituindo os valores das massas, temos:
200 c_A = 3 cdot 100 c_B
2 c_A = 3 c_B
c_A = dfrac 32 c_B
c_A = 1,5 c_B
d) a massa específica de B é 2,5 vezes maior que a de B.
Incorreta. A massa específica é uma propriedade física de um material que descreve a quantidade de massa de uma substância contida em uma unidade de volume específica. Em outras palavras, a massa específica representa a densidade de massa de uma substância.
Assim, não podemos tirar essa conclusão com base nas informações dadas, pois a questão fornece as massas dos blocos A e B, mas não menciona os volumes.
Portanto, a resposta correta é a alternativa (c).
