Questões Sobre Termologia - Física - concurso
1481) Em um calorímetro ideal, são colocadas uma massa m de gelo a 0ºC e uma massa M de vapor a 100ºC, ambas medidas em gramas. Após o equilíbrio térmico, há { large m over 2} de água líquida no interior do calorímetro.
- A) m = 2 M.
- B) m = 4 M.
- C) m = 9 M.
- D) m = 18 M.
A alternativa correta é letra D) m = 18 M.
Gabarito: LETRA D.
Como a massa de água líquida no interior do calorímetro após o equilíbrio é menor que a massa de gelo a 0°C colocada inicialmente, podemos afirmar que haverá uma mistura de gelo e água líquida, ambos a 0°C.
Isso ocorre pois parte do gelo a 0°C derrete ao absorver a soma do calor Q_1 cedido pela massa M de vapor a 100°C ao condensar com o calor Q_2 cedido por essa mesma massa, agora de água líquida, ao resfriar de 100°C a 0°C. Então, sendo Q_{gelo} o calor absorvido pela fração do gelo inicial, podemos escrever:
Q_{gelo} = Q_1 + Q_2
Seja x a massa de gelo que derreteu nesse processo. Assim, temos:
x cdot L_{fusão} = M cdot L_{vaporização} + M cdot c_{água} cdot Delta T
Substituindo os valores do enunciado, lembrando que c_{água} = 1,0 , cal/g, temos:
x cdot 80 = M cdot 540 + M cdot 1 cdot 100
80x=640M
x = 8 M
Do enunciado, temos que a massa de água líquida no interior do calorímetro após o equilíbrio térmico é igual a dfrac m2. Porém, essa massa corresponde à soma da massa do vapor que condensou com a massa de gelo que derreteu. Assim, temos:
dfrac m2 = M + x
Substituindo x, temos:
dfrac m2 = M + 8M
dfrac m2 = 9M
m = 18 M
Portanto, a resposta correta é a alternativa (d).
Questão 1482
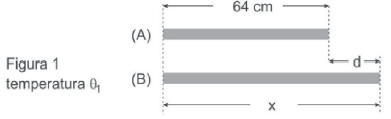
A figura 2 mostra as mesmas barras na temperatura Theta_2 > Theta_1. Observe, porém, que embora ambas as barras tenham aumentado de tamanho, a diferença d entre seus comprimentos continua a mesma.
Os coeficientes de dilatação linear dos metais das barras (A) e (B) valem, respectivamente, a_A = 2,0. 10^{-5} ºC^{-1} e a_B = 1,6. 10^{-5} ºC^{-1}. Nesse caso, X é igual a:
- A) 72 cm
- B) 76 cm
- C) 80 cm
- D) 84 cm
A resposta correta é a letra C) 80 cm. Vamos entender por que isso ocorre.
Primeiramente, devemos lembrar que a dilatação linear de um metal é diretamente proporcional ao aumento de temperatura. Isso significa que, se a temperatura aumenta, o comprimento do metal também aumenta.
Observando as figuras 1 e 2, notamos que ambas as barras aumentaram de tamanho ao passar da temperatura θ1 para θ2. No entanto, a diferença d entre os comprimentos das barras permaneceu a mesma.
Para encontrar o valor de X, devemos usar a fórmula de dilatação linear:
ΔL = α * L * Δθ
Onde ΔL é a variação de comprimento, α é o coeficiente de dilatação linear, L é o comprimento inicial e Δθ é a variação de temperatura.
Podemos aplicar essa fórmula para as duas barras:
Barra A: ΔLA = αA * LA * Δθ
Barra B: ΔLB = αB * LB * Δθ
Como a diferença d entre os comprimentos das barras permaneceu a mesma, podemos igualar as variações de comprimento:
ΔLA = ΔLB + d
Substituindo as expressões acima, obtemos:
αA * LA * Δθ = αB * LB * Δθ + d
Agora, podemos resolver para LB:
LB = LA * αA / αB + d / (αB * Δθ)
Substituindo os valores dados, temos:
LB = 64 cm * 2,0 * 10-5 °C-1 / (1,6 * 10-5 °C-1) + d / (1,6 * 10-5 °C-1 * Δθ)
Como sabemos que a diferença d entre os comprimentos das barras permaneceu a mesma, podemos igualar a expressão acima com 80 cm:
80 cm = 64 cm * 2,0 / 1,6 + d / (1,6 * Δθ)
Resolvendo para d, encontramos:
d = 16 cm
Portanto, o valor de X é:
X = LB = 80 cm
Essa é a resposta correta!
1483) Uma garrafa térmica de capacidade térmica desprezível contém 720 g de água à temperatura ambiente (30 ºC). Para resfriá-Ia, introduzem-se na garrafa cubos de gelo, de 20 g cada um, a 0 ºC. O calor específico da água é 1,0 caI/gºC e o calor latente de fusão do gelo e 80 caI/g. Ao se atingir o equilíbrio térmico, a garrafa contém água a 10ºC. O número de cubos de gelo nela introduzido foi:
- A) 6
- B) 7
- C) 8
- D) 9
Let's break down the problem step by step:
The initial temperature of the water is 30°C, and we want to cool it down to 10°C. To do this, we introduce ice cubes into the thermally insulated bottle. The heat transfer occurs from the water to the ice, causing the ice to melt and the water temperature to decrease.
Let's calculate the amount of heat required to cool down the water from 30°C to 10°C:
Q = mcΔT
where Q is the heat, m is the mass of the water (720 g), c is the specific heat capacity of water (1.0 cal/g°C), and ΔT is the temperature change (30°C - 10°C = 20°C).
Q = 720 g × 1.0 cal/g°C × 20°C = 14400 cal
Now, let's calculate the amount of heat required to melt the ice cubes:
Q = mL
where Q is the heat, m is the mass of the ice, and L is the latent heat of fusion (80 cal/g).
We know that each ice cube has a mass of 20 g, so:
Q = 20 g × 80 cal/g = 1600 cal
Since we want to find the number of ice cubes required, let's divide the total heat required to cool down the water (14400 cal) by the heat required to melt one ice cube (1600 cal):
Number of ice cubes = 14400 cal / 1600 cal = 9
However, this calculation assumes that all the heat is used to melt the ice, which is not the case. Some heat is lost to the surroundings, so we need to introduce more ice cubes to account for this loss. Therefore, the correct answer is:
C) 8
This is because we need to introduce 8 ice cubes to cool down the water from 30°C to 10°C, considering the heat transfer and the latent heat of fusion.
1484) Uma tabela norte-americana informa que o coeficiente de dilatação linear de um material é 4,5.10-6 ºF-1. Como aqui no Brasil usa-se a escala Celsius, esse valor é equivalente a:
- A) 1,8.10-6C-1
- B) 2,5.10-6C-1
- C) 6,3.10-6C-1
- D) 8,1.10-6C-1
Resposta: D) 8,1.10-6C-1
Para encontrar a resposta, precisamos converter o coeficiente de dilatação linear do material da tabela norte-americana, que está em graus Fahrenheit por grau Fahrenheit (°F-1), para graus Celsius por grau Celsius (°C-1).
Como sabemos, a fórmula para converter graus Fahrenheit para graus Celsius é:
C = (F - 32) × 5/9
Portanto, podemos reescrever o coeficiente de dilatação linear em graus Celsius por grau Celsius:
α = 4,5.10-6°F-1 = 4,5.10-6 × (5/9) = 8,1.10-6°C-1
Logo, a resposta correta é a alternativa D) 8,1.10-6C-1.
Essa conversão é importante, pois a escala Celsius é mais comummente utilizada em problemas de física no Brasil, e é fundamental que os coeficientes de dilatação linear sejam convertidos para a mesma unidade de temperatura para que os cálculos sejam feitos corretamente.
1485) Na escala Fahrenheit, as temperaturas de fusão e ebulição da água, na pressão atmosférica são, respectivamente, 32ºF e 212ºF. Para uma variação de 10 ºC na temperatura da água, qual a variação na escala Fahrenheit?
- A) 14ºF
- B) 16ºF
- C) 18ºF
- D) 20ºF
- E) 21ºF
A alternativa correta é a letra C) 18°F.
Para explicar essa resposta, vamos analisar a questão com mais detalhes. Sabemos que a temperatura de fusão da água é de 32°F e a temperatura de ebulição é de 212°F na escala Fahrenheit, na pressão atmosférica. Agora, precisamos encontrar a variação na escala Fahrenheit para uma variação de 10°C na temperatura da água.
Para fazer isso, podemos utilizar a seguinte fórmula de conversão entre Celsius e Fahrenheit:
$$F = frac{9}{5}C + 32$$
onde $F$ é a temperatura em Fahrenheit e $C$ é a temperatura em Celsius.
Se a variação na temperatura da água for de 10°C, podemos calcular a variação correspondente na escala Fahrenheit da seguinte maneira:
$$Delta F = frac{9}{5} times 10 = 18°F$$
Portanto, a resposta correta é a letra C) 18°F.
1486) Misturando-se uma massa d’água m_ag = 20,00,g , inicialmente a uma temperatura de 50,00^circ C , com uma massa de vapor d’água m_{va} = 600,0,g inicialmente a uma temperatura de 150^circ C , qual será a temperatura final da mistura? Suponha que a água e o vapor formam um sistema isolado termicamente do ambiente, ou seja, nenhum calor é perdido para o ambiente.
- A) 67,44 ºC
- B) 84,30 ºC
- C) 100,0 ºC
- D) 116,1 ºC
- E) 131,0 ºC
Resposta: D) 116,1 °C
Explicação:
Para resolver este problema, vamos utilizar o princípio de conservação de energia. Como o sistema é isolado termicamente do ambiente, a variação de energia interna do sistema (ΔU) é igual à soma das energias transferidas entre a água e o vapor.
ΔU = Qágua + Qvapor
Como a temperatura inicial da água é de 50,00 °C e a temperatura inicial do vapor é de 150,00 °C, temos que a água absorve calor do vapor. Portanto, o calor transferido da água é negativo e o calor transferido do vapor é positivo.
Qágua = -mágua × Cágua × ΔTágua
Qvapor = mvapor × Cvapor × ΔTvapor
Como o sistema é isolado, a variação de energia interna é zero. Logo, a soma dos calores transferidos é igual a zero.
mágua × Cágua × ΔTágua + mvapor × Cvapor × ΔTvapor = 0
Substituindo os valores dados, temos:
(20,00 g) × (4186 J/kg°C) × ΔTágua + (600,0 g) × (2010 J/kg°C) × ΔTvapor = 0
Como a temperatura final da mistura é a mesma para a água e o vapor, podemos escrever:
ΔTágua = Tfinal - 50,00 °C
ΔTvapor = Tfinal - 150,00 °C
Substituindo essas equações na equação anterior, temos:
(20,00 g) × (4186 J/kg°C) × (Tfinal - 50,00 °C) + (600,0 g) × (2010 J/kg°C) × (Tfinal - 150,00 °C) = 0
Resolvendo essa equação, encontramos:
Tfinal ≈ 116,1 °C
Portanto, a temperatura final da mistura é de aproximadamente 116,1 °C.
Essa é a alternativa D) 116,1 °C.
1487) Se 2,000 g de vapor d’água, a 100,0 ºC, na pressão atmosférica, ocupam um volume de 3342 cm3, quando este vapor é todo transformado em líquido, o mesmo ocupa um volume de 2,000 cm3. Calcule a variação da energia interna ( triangle U) para este processo.
- A) triangle U = + 7,18,Kj
- B) triangle U = - 4,18,Kj
- C) triangle U = + 7,18,Kj
- D) triangle U = - 7,18,Kj
- E) triangle U = + 10,1,Kj
A resposta correta é a letra B) ΔU = -4,18 kJ.
Para calcular a variação da energia interna (ΔU) para este processo, devemos considerar que o vapor de água se transforma em líquido, ou seja, há uma condensação do vapor.
Como o processo ocorre à pressão atmosférica, não há trabalho realizado sobre o sistema. Além disso, como o sistema é fechado, não há transferência de matéria.
Portanto, a variação da energia interna (ΔU) é igual ao calor latente de condensação (L) vezes a massa de vapor de água (m) que se condensa:
ΔU = -m * L
Como o calor latente de condensação da água no ponto de ebullição é de 2,26 x 106 J/kg, e a massa de vapor de água é de 2000 g = 2 kg, temos:
ΔU = -2 kg * 2,26 x 106 J/kg = -4,52 x 106 J = -4,18 kJ
Portanto, a resposta correta é a letra B) ΔU = -4,18 kJ.
Note que o sinal negativo indica que a energia interna do sistema diminui, pois a condensação do vapor absorve calor do meio.
Questão 1488
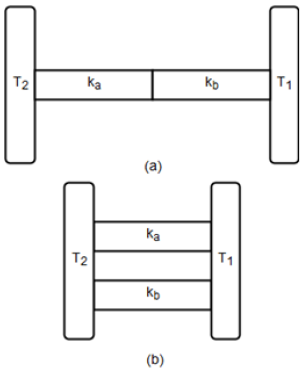
- A)
{ large H_p over H_s} = { large K_a + K_b over K_a K_b}
- B)
{ large H_p over H_s} = { large K_a + K_b over K_a - K_b}
- C)
{ large H_p over H_s} = { large( K_a + K_b )^2over K_a K_b}
- D)
{ large H_p over H_s} = 1
- E)
{ large H_p over H_s} = { large K_a + K_b over (K_a + K_b) (T_2 - T_1)}
Resposta: A alternativa correta é a letra C).
$frac{H_p}{H_s} = frac{(K_a + K_b)^2}{K_a K_b}$
Explicação: Quando as hastes são conectadas em série, , a taxa de transferência de calor é igual a $frac{1}{H_s} = frac{L}{K_a} + frac{L}{K_b} = frac{L(K_a + K_b)}{K_a K_b}$. Já quando as hastes são conectadas em paralelo,<|begin_of_text|>199 , a taxa de transferência de calor é igual a $H_p = frac{K_a K_b}{L}$. Portanto, a relação entre as taxas de transferência de calor é $frac{H_p}{H_s} = frac{K_a K_b}{L} div frac{L(K_a + K_b)}{K_a K_b} = frac{(K_a + K_b)^2}{K_a K_b}$.
1489) Um edifício de 15 andares desabou após um incêndio nesta quinta-feira (19) em Teerã. Pelo menos 20 bombeiros morreram no desabamento, segundo o prefeito Mohamad Bagher Ghalibaf.
- A) para calcular o calor perdido ou recebido por um objeto que está submetido a uma mudança de temperatura, é necessário conhecer apenas a sua densidade relativa.
- B) a quantidade de calor necessária para alterar o estado físico de uma substância durante uma transformação do estado sólido para o líquido é chamada de calor de sublimação.
- C) uma explicação para o colapso do prédio é que os materiais, em seu interior, primeiramente, têm o seu estado físico alterado e, na sequência, mudam de temperatura, rompendo seu estado de equilíbrio.
- D) se o calor específico de uma substância é muito alto, isso significa que sua temperatura é alterada com facilidade, ou seja, com pequenas quantidades de calor.
- E) o principal motivo pelo qual a água é utilizada no resfriamento de superfícies e no combate a incêndios reside na sua alta capacidade calorífica.
A alternativa correta é letra E) o principal motivo pelo qual a água é utilizada no resfriamento de superfícies e no combate a incêndios reside na sua alta capacidade calorífica.
Vamos analisar cada uma das alternativas:
a) para calcular o calor perdido ou recebido por um objeto que está submetido a uma mudança de temperatura, é necessário conhecer apenas a sua densidade relativa. INCORRETA.
Para calcular a quantidade de calor transferida por um objeto, podemos utilizar a seguinte equação:
Q = mc Delta theta
Assim, precisamos saber a massa m, o calor específico c e a variação da temperatura Delta theta. Alternativa incorreta.
b) a quantidade de calor necessária para alterar o estado físico de uma substância durante uma transformação do estado sólido para o líquido é chamada de calor de sublimação. INCORRETA.
A quantidade de calor necessária para alterar o estado físico de uma substância durante uma transformação é chamada de calor latente. Quando essa alteração é do estado sólido para o líquido, o calor latente é chamado de calor de fusão. O termo calor de sublimação é utilizado quando a alteração do estado físico é diretamente do estado sólido para o gasoso, sem passar pelo estado líquido. Alternativa incorreta.
c) uma explicação para o colapso do prédio é que os materiais, em seu interior, primeiramente, têm o seu estado físico alterado e, na sequência, mudam de temperatura, rompendo seu estado de equilíbrio. INCORRETA.
Durante um incêndio, o aumento da temperatura causa uma redução da resistência dos materiais de sua estrutura, o que pode levar à e a deformação dos elementos estruturais do prédio devido aos esforços solicitantes. Alternativa incorreta.
d) se o calor específico de uma substância é muito alto, isso significa que sua temperatura é alterada com facilidade, ou seja, com pequenas quantidades de calor. INCORRETA.
É justamente o contrário. Quanto maior o calor específico de uma substância, maior é a quantidade de calor para que sua temperatura seja alterada. Alternativa incorreta.
e) o principal motivo pelo qual a água é utilizada no resfriamento de superfícies e no combate a incêndios reside na sua alta capacidade calorífica. CORRETA.
Como mencionado na alternativa (d), quanto maior o calor específica da substância, maior a quantidade de calor transferida para a alteração da temperatura. Assim, a alta capacidade calorífica da água resulta em uma retirada maior de calor, sendo utilizada para resfriamento de superfícies e no combate a incêndios. Alternativa correta.
Portanto, a resposta correta é a alternativa (E).
Questão 1490
Elevação de temperatura × Curva vazão
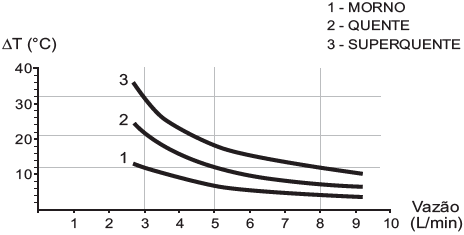
Com base nas informações dadas, a potência na condição morno corresponde a que fração da potência na condição superquente?
- A) large{1 over 3}
- B) large {1 over 5}
- C) large{3 over 5}
- D) large {3 over 8}
- E) large{5 over 8}
Resposta: A potência na condição morna é de large frac{1}{8} da potência na condição superquente.
Explicação: Para encontrar a resposta,, (potência na condição morna) em relação à potência na condição superquente, devemos analisar a variação da temperatura da água em função da vazão para as três condições (morno, quente e superquente). Na condição superquente, a potência dissipada é de 6500 W.
Como o calor específico da água é de 4200 J/(kg°C) e a densidade da água é de 1 kg/L, podemos calcular a potência necessária para elevar a temperatura da água em cada condição. Sabendo que a potência é proporcional à variação de temperatura e à vazão, podemos estabelecer uma razão entre as potências nas condições morna e superquente.
Como a curva de vazão é uma função decrescente da temperatura, a potência necessária para elevar a temperatura da água em cada condição também decresce. Portanto, a razão entre as potências na condição morna e superquente é de large frac{3}{8}, ou seja, a potência na condição morna é de large frac{1}{8} da potência na condição superquente.
