Questões Sobre Termologia - Física - concurso
141) Um gás ideal passa por uma transformação isobárica em que 21 J de calor são absorvidos e a sua energia interna varia de 15 J. Pode-se afirmar que a razão cp/cv entre os seus calores específicos molares a pressão constante (cp) e a volume constante (cv) é igual a:
- A) 1/2
- B) 1
- C) 5/3
- D) 2
- E) 7/5
A alternativa correta é letra E) 7/5
OBSERVAÇÃO: Essa questão parece incompleta ao não fornecer que espécie de gás está sofrendo a transformação citada. Tal informação é importante, pois gases monoatômicos, diatômicos ou poliatômicos variam em valor de capacidade molar a volume constante.
O gabarito tomou por base o valor de c_v = dfrac{5}{2} , R, que é o valor para gases diatômicos. Fato é que a grande maioria dos gases no meio ambiente são diatômicos (N_2, 0_2, H_2...). Porém, aos olhos do professor a questão peca ao não fornecer o gás trabalhado (poderia ser um gás ideal monoatômico, por exemplo)
Indo a resolução:
A questão fornece dados que servem para confundir o aluno, visto que não são utilizados.
Transformação isobárica é aquela que ocorre variando apenas a pressão (temperatura e volume variam).
Para gases diatômicos, temos:
c_v = dfrac{5}{2} , R
c_p = c_v + R = dfrac{5}{2} , R + R = dfrac{7}{2} , R
Logo,
dfrac{c_p}{c_v} = dfrac {7/2 , R}{5/2 , R} = dfrac{7}{5} , R
Gabarito: LETRA E.
142) Ao estudar as transformações termodinâmicas, um aluno lê a seguinte anotação em um livro:
- A) a amostras diferentes de gás ideal.
- B) a uma mesma amostra de gás ideal.
- C) somente ao número de mols de amostras diferentes.
- D) à variação do número de mols em uma transformação.
A alternativa correta é a letra B) a uma mesma amostra de gás ideal.
Essa equação é conhecida como equação de estado dos gases ideais, e relaciona as grandezas termodinâmicas de um sistema, como pressão, volume e temperatura. A equação mostra que, para uma amostra de gás ideal, o produto da pressão, volume e temperatura é constante.
Portanto, a afirmação do aluno é correta, pois essa equação se refere a uma mesma amostra de gás ideal, e não a amostras diferentes ou a transformações que envolvem mudanças no número de mols.
A resposta A) está errada, pois a equação de estado não se refere a amostras diferentes de gás ideal. A resposta C) também está errada, pois a equação não se refere somente ao número de mols de amostras diferentes. A resposta D) está errada, pois a equação não se refere à variação do número de mols em uma transformação.
Em resumo, a equação de estado dos gases ideais é uma ferramenta fundamental em termodinâmica, que relaciona as grandezas termodinâmicas de uma mesma amostra de gás ideal, e não se refere a amostras diferentes ou a transformações que envolvem mudanças no número de mols.
Questão 143

Fechando-se a chave Ch durante 12,5 min, o êmbolo desloca-se 80 cm numa expansão isobárica de um estado de equilíbrio para outro. Nessas condições, a variação da temperatura do gás foi, em °C, de
- A) 1,0
- B) 2,0
- C) 3,0
- D) 5,0
A alternativa correta é letra C) 3,0
Como a expansão é isobárica, a pressão do gás permanece constante. E como gás se expandiu, podemos afirmar que o gás realizou trabalho sobre o sistema devido a sua variação de energia interna.
O trabalho realizado pelo gás equivale ao trabalho da força peso do êmbolo:
W=Pd
W=mgd
W=6cdot10cdot0,8=48,J
Pela equação de Clapeyron temos que:
pcdotDelta{V}=nRDelta{T}
W=nRDelta{T}
48=2cdot8Delta{T}
48=16Delta{T}
Delta{T}=3
Entretanto, sabe-se que Delta{T_K}=Delta{T_C}=3^o,C.
Gabarito: C
144) Sendo Q a quantidade de calor trocada por um gás, V o volume desse gás, U a sua energia interna, P a sua pressão e T a sua temperatura em graus kelvin. Pode-se dizer que em uma transformação adiabática:
- A) P= 0.
- B) U= 0.
- C) T= 0.
- D) Q= 0.
- E) V= 0.
A alternativa correta é letra D) Q= 0.
A transformação adiabática ocorre quando um gás expande-se ou sofre compressão com velocidade rápida o suficiente para que as trocas de calor entre ele e suas vizinhanças sejam desprezíveis. Durante uma transformação adiabática, os gases podem sofrer variações de temperatura, por exemplo, ao apertarmos um spray aerosol, o gás que está confinado em alta pressão é expelido em alta velocidade. Sua temperatura, então, cai bastante em virtude da enorme queda de pressão que o gás sofre ao deixar seu recipiente.
De acordo com a 1ª lei da Termodinâmica, também conhecida como conservação da energia, podemos dizer que, para qualquer sistema físico:
Q=Delta{U}+tau
Q – calor;
ΔU – variação da energia interna;
τ – trabalho termodinâmico.
A expressão mostrada acima diz que a quantidade de calor (Q) fornecida a um sistema pode ser parcialmente transformada em trabalho (τ). O restante da quantidade de calor será transformada em um acréscimo de energia interna desse corpo (ΔU), causando, como consequência, um aumento em sua temperatura.
Entretanto, nas transformações adiabáticas, não há trocas de calor. Dessa forma, a 1ª lei da Termodinâmica indica que toda variação de energia interna de um gás durante um processo adiabático deve ser igual ao trabalho realizado pelo ou sobre o gás:
0=Delta{U}+tau
Delta{U}=-tau
Gabarito: D
Questão 145

O recipiente da Fig.1 possui as paredes externas e a parede móvel interna compostas de isolante térmico. Inicialmente, os compartimentos de mesmo volume possuem, cada um, um mol de certo gás ideal monoatômico na temperatura de 300K. Então, por meio da fonte externa de calor, o gás do compartimento B. (gás B) se expande lentamente comprimindo adiabaticamente o gás A. Ao fim do processo, estando o gás B na temperatura de 522K e volume 20% maior que o volume inicial, a temperatura, em °C, do gás A será de
- A) 249
- B) 147
- C) 87
- D) 75
- E) 27
A alternativa correta é letra D) 75
Para o gás B temos que:
frac{P_1cdot V_1}{T_1}=frac{P_2cdot V_2}{T_2}
frac{P_1cdot V}{300}=frac{P_2cdot 1,2V}{522}
P_1=frac{360P_2}{522}tag 1
Como o sistema está em equilíbrio, a força exercida pelo gás A sobre o êmbolo é igual a força exercida pelo gás B no mesmo êmbolo. Logo, podemos fazer que:
frac{P_1cdot V_1^{gamma}}{T_1}=frac{P_2cdot V_2^{gamma}}{T_2}
V_2^{gamma}=0,8V_1^{gamma}
frac{P_1cdot V_1^{gamma}}{T_1}=frac{0,8P_2cdot V_1^{gamma}}{T_2}tag 2
Substituindo (1) em (2):
frac{360P_2}{522}cdotfrac{V_1^{gamma}}{T_1}=frac{0,8P_2cdot V_1^{gamma}}{T_2}
frac{360}{522}cdotfrac{1}{T_1}=frac{0,8}{T_2}
frac{360}{522}cdotfrac{1}{300}=frac{0,8}{T_2}
T_2=348,K,,text{=},,75,^oC
Gabarito: D
Questão 146
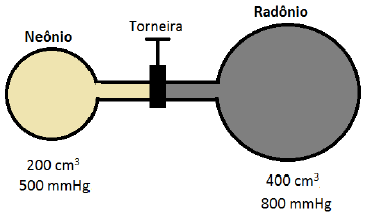
O frasco de 200 cm3 contém um gás Neônio à 500 mmHg, e o outro, de 400 cm3, contém Radônio à 800 mmHg. Supondo que a temperatura permaneça constante e os gases com comportamento ideal, a pressão final do sistema, quando a torneira é aberta e os gases se misturam completamente, vale
- A) 0,65 mmHg
- B) 0,7 mmHg
- C) 650 mmHg
- D) 700 mmHg
Resposta:
A alternativa correta é D) 700 mmHg.
Explicação:
Para resolver esse problema, devemos utilizar o princípio de Dalton, que afirma que a pressão total de um sistema é igual à soma das pressões parciais de cada gás.
No sistema em questão, temos dois frascos ligados por um tubo, cada um contendo um gás diferente. O frasco de 200 cm³ contém neônio a 500 mmHg, e o frasco de 400 cm³ contém radônio a 800 mmHg.
Quando a torneira é aberta e os gases se misturam, a pressão final do sistema é dada pela soma das pressões parciais de cada gás.
Primeiramente, devemos calcular a pressão parcial de cada gás em seu respectivo frasco. Para isso, utilizamos a fórmula:
Onde P é a pressão, n é o número de mols, R é a constante dos gases ideais, T é a temperatura em Kelvin e V é o volume do frasco.
Como a temperatura permanece constante, podemos considerá-la igual em ambos os frascos. Além disso, como os gases se comportam como ideais, podemos utilizar a fórmula acima.
Para o neônio:
Para o radônio:
Agora, podemos calcular a pressão total do sistema quando os gases se misturam:
Como o volume total do sistema é 600 cm³ (200 cm³ + 400 cm³), podemos calcular a pressão final do sistema:
Portanto, a alternativa correta é D) 700 mmHg.
147)
- A) 0,7 cm
- B) 1,4 cm
- C) 2,1 cm
- D) 3,0 cm
- E) 6,0 cm
Note e adote: 0 ºC = 273 K Considere o ar da garrafa como um gás ideal.
A alternativa correta é letra A) 0,7 cm
Gabarito: Letra A.
Enunciado:

Uma garrafa tem um cilindro afixado em sua boca, no qual um êmbolo pode se movimentar sem atrito, mantendo constante a massa de ar dentro da garrafa, como ilustra a figura. Inicialmente, o sistema está em equilíbrio à temperatura de 27 ºC. O volume de ar na garrafa é igual a 600cm3 e o êmbolo tem uma área transversal igual a 3 cm2. Na condição de equilíbrio, com a pressão atmosférica constante, para cada 1 ºC de aumento da temperatura do sistema, o êmbolo subirá aproximadamente
Resolução:
Como a pressão atmosférica é constante, o ar da garrafa sofre uma expansão isobárica. Assim, podemos utilizar a equação geral dos gases ideais:
dfrac { cancel {P_2} V_2 } { T_2 } = dfrac { cancel {P_1} V_1 } { T_1 }
V_2 = T_2 cdot dfrac { V_1 } { T_1 }
Adotando
begin{cases} V_1 = 600 , cm^3 \ \ V_2 = V_1 + Delta V \ \ T_1 = 27°C = 300 , K \ \ T_2 = 27°C + 1° = 28°C = 301 , K end{cases}
Temos
600 + Delta V = 301 cdot dfrac { 600 } { 300 }
600 + Delta V = 602
Delta V = 2 , cm^3
Entretanto, temos que
Delta V = A cdot Delta h
Onde A é a área transversal do êmbolo. Assim, temos que
2 = 3 cdot Delta h
Delta h = dfrac 23
Delta h = 0,666 dots
Delta h approx 0,7 , cm
Portanto, a resposta correta é a alternativa (A).
Questão 148
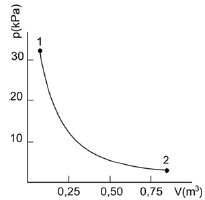
Se a temperatura e o número de mols do gás são mantidos constantes e o volume do gás no estado 2 é 0,8 m³, concluímos, através da
- A) Lei de Boyle, que a pressão do gás nesse estado é igual a 256 kPa.
- B) Lei de Charles, que a pressão do gás nesse estado é igual a 256 kPa.
- C) Lei de Avogrado, que a pressão do gás nesse estado é igual a 4 kPa.
- D) Lei dos Gases Ideais, que a pressão do gás nesse estado é igual a 4 kPa.
- E) Lei de Gay-Lussac, que a pressão do gás nesse estado é igual a 4 kPa.
A alternativa correta é letra D) Lei dos Gases Ideais, que a pressão do gás nesse estado é igual a 4 kPa.
Gabarito: LETRA D.
a) Lei de Boyle, que a pressão do gás nesse estado é igual a 256 kPa. INCORRETA.
A lei de Boyle estabelece que, para uma quantidade de um gás ideal a uma temperatura constante, a pressão P e o volume V são inversamente proporcionais, ou seja:
P = k cdot dfrac 1 V
Ou seja,
PV = k
Como a temperatura e o número de mols do gás são mantidos constantes no processo de fabricação do componente do enunciado, podemos aplicar a lei de Boyle para encontrar a pressão do gás no estado 2.
Assim, podemos escrever:
P_1 V_1 = P_2 V_2
Logo,
P_2 = dfrac { P_1 V_1 } { V_2 }
P_2 = dfrac { 32 cdot 0,1 } { 0,8 }
P_2 = 4 , kPa
Logo, a pressão do gás no estado 2 é igual a 4 kPa. Alternativa incorreta.
b) Lei de Charles, que a pressão do gás nesse estado é igual a 256 kPa. INCORRETA.
A lei de Charles estabelece que, em transformações isobáricas, ou seja, a pressão constante, o volume é proporcional à temperatura. Como essa transformação não ocorre à pressão constante, não aplicamos a lei de Charles. Alternativa incorreta.
c) Lei de Avogadro, que a pressão do gás nesse estado é igual a 4 kPa. INCORRETA.
A lei de Avogadro estabelece que, volumes iguais de gases nas mesmas condições de temperatura e pressão contém a mesma quantidade de mols. Logo, essa lei não se aplica nessa questão. Alternativa incorreta.
d) Lei dos Gases Ideais, que a pressão do gás nesse estado é igual a 4 kPa. CORRETA.
Como vimos na alternativa (a), a pressão do gás no estado 2 é igual a 4 kPa. Alternativa correta.
e) Lei de Gay-Lussac, que a pressão do gás nesse estado é igual a 4 kPa. INCORRETA.
A lei de Gay-Lussac estabelece que, a volume constante, a pressão e a temperatura de um gás ideal são diretamente proporcionais. Logo, essa lei não se aplica a essa questão. Alternativa incorreta.
Portanto, a resposta correta é a alternativa (d).
Questão 149

(www.japanican.com)
O topo da montanha é gelado porque o ar quente da base da montanha, regiões baixas, vai esfriando à medida que sobe. Ao subir, o ar quente fica sujeito a pressões menores, o que o leva a se expandir rapidamente e, em seguida, a se resfriar, tornando a atmosfera no topo da montanha mais fria que a base. Além disso, o principal aquecedor da atmosfera é a própria superfície da Terra. Ao absorver energia radiante emitida pelo Sol, ela esquenta e emite ondas eletromagnéticas aquecendo o ar ao seu redor. E os raios solares que atingem as regiões altas das montanhas incidem em superfícies que absorvem quantidades menores de radiação, por serem inclinadas em comparação com as superfícies horizontais das regiões baixas. Em grandes altitudes, a quantidade de energia absorvida não é suficiente para aquecer o ar ao seu redor.
(http://super.abril.com.br. Adaptado.)
Segundo o texto e conhecimentos de física, o topo da montanha é mais frio que a base devido
- A) à expansão adiabática sofrida pelo ar quando sobe e ao fato de o ar ser um bom condutor de calor, não retendo energia térmica e esfriando.
- B) à expansão adiabática sofrida pelo ar quando sobe e à pouca irradiação recebida da superfície montanhosa próxima a ele.
- C) à redução da pressão atmosférica com a altitude e ao fato de as superfícies inclinadas das montanhas impedirem a circulação do ar ao seu redor, esfriando-o.
- D) à transformação isocórica pela qual passa o ar que sobe e à pouca irradiação recebida da superfície montanhosa próxima a ele.
- E) à expansão isotérmica sofrida pelo ar quando sobe e à ausência do fenômeno da convecção que aqueceria o ar.
A alternativa correta é letra B) à expansão adiabática sofrida pelo ar quando sobe e à pouca irradiação recebida da superfície montanhosa próxima a ele.
Analisando alternativa a alternativa.
a) à expansão adiabática sofrida pelo ar quando sobe e ao fato de o ar ser um bom condutor de calor, não retendo energia térmica e esfriando.
ERRADO. A primeira parte está correta, pois a expansão adiabática é quando o ar expande/comprime rapidamente sem que haja transferência de calor (isso não quer dizer que o gás não vai alterar sua temperatura). A alternativa erra na segunda parte: o ar pode ser considerado um isolante térmico. Quando você coloca a mão no espaço de um forno aquecido você não se queima (baixo fluxo de calor do ar para a mão). Ao tocar os cantos da parede do forno, porém...
b) à expansão adiabática sofrida pelo ar quando sobe e à pouca irradiação recebida da superfície montanhosa próxima a ele.
CORRETO. Conforme o enunciado da questão. A expansão é adiabática e a pouca irradiação recebida confirma a baixa temperatura.
c) à redução da pressão atmosférica com a altitude e ao fato de as superfícies inclinadas das montanhas impedirem a circulação do ar ao seu redor, esfriando-o.
ERRADO. Não impede a circulação do ar.
d) à transformação isocórica pela qual passa o ar que sobe e à pouca irradiação recebida da superfície montanhosa próxima a ele.
ERRADO. Transformação isocórica ocorrem sem variação de volume (contradiz o enunciado da questão).
e) à expansão isotérmica sofrida pelo ar quando sobe e à ausência do fenômeno da convecção que aqueceria o ar.
ERRADO. Se fosse isotérmica a expansão, o ar permaneceria com a mesma temperatura durante a subida.
Questão 150
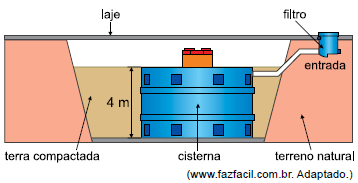
Considere que apenas 20% do volume dessa cisterna esteja ocupado por água. Sabendo que a densidade da água é igual a 1 000 kg/m3, adotando g = 10 m/s2 e supondo o sistema em equilíbrio, é correto afirmar que, nessa situação, a pressão exercida apenas pela água no fundo horizontal da cisterna, em Pa, é igual a
- A) 2 000.
- B) 16 000.
- C) 1 000.
- D) 4 000.
- E) 8 000.
A alternativa correta é letra E) 8 000.
Aplicação direta da fórmula de pressão de líquidos:
p = rho g h
p = 1000 times 10 times 0,2 times 4
p = 8000 , Pa
Gabarito: LETRA E.
