Questões Sobre Termologia - Física - concurso
1511) Os fenômenos macroscópicos são, a rigor, irreversíveis a menos de situações experimentalmente controladas “quasereversíveis”. A expansão livre de um gás, por exemplo, é um fenômeno irreversível. Um outro exemplo é a passagem espontânea de calor de um corpo para outro de menor temperatura (ou mais frio). A lei física ligada a irreversibilidade dos fenômenos macroscópicos corresponde a:
- A) Lei de conservação de energia;
- B) Segunda lei da termodinâmica;
- C) Primeira lei da termodinâmica;
- D) Lei zero da termodinâmica;
- E) Segunda lei de Newton.
A alternativa correta é letra B) Segunda lei da termodinâmica;
Um processo é dito irreversível, se o sistema e todas as partes que compõem sua vizinhança não puderem ser restabelecidos exatamente aos seus respectivos estados iniciais após o processo ter ocorrido.
A segunda lei da termodinâmica declara que certos processos são irreversíveis. Quando, por exemplo, colocamos dois corpos em contato térmico feito por uma parede diatérmica (que transfere calor), o fluxo de calor é sempre direcionado no sentido da maior para a menor temperatura, até que o sistema composto alcance um novo estado de equilíbrio termodinâmico. Após esse processo ocorrer, não seria possível a energia térmica transferida retornar ao seu estado inicial.
Analisemos as alternativas:
A lei física ligada a irreversibilidade dos fenômenos macroscópicos corresponde a:
a) Lei de conservação de energia; Falso. A conservação da energia está associada à primeira lei da termodinâmica.
b) Segunda lei da termodinâmica; Esse é o gabarito!
c) Primeira lei da termodinâmica; Falso. Vide letra A.
d) Lei zero da termodinâmica; Falso. Essa lei trata das condições para haver equilíbrio térmico entre sistemas.
e) Segunda lei de Newton. Falso. Trata da definição de força aplicada a um corpo.
Gabarito: B
Questão 1512
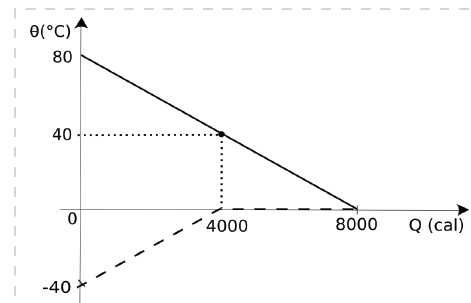
- A) 0 g.
- B) 50 g.
- C) 100 g.
- D) 150 g.
- E) 200 g.
A alternativa correta é letra D) 150 g.
ALTERNATIVA CORRETA: LETRA D
O gelo recebe 4000 cal para variar sua temperatura de -40°C até 0°C, logo:
Q=m.C_p.Delta T
4000=m_{gelo}.0,5.(0-(-40))
m_{gelo}=frac{4000}{20}=200g
Após a elevação de temperatura, o gelo passou a ser fundido, e recebeu 4000 cal, assim:
Q=m.L
4000=m.80
m=frac{4000}{80}=50g
O calor recebido só foi suficiente para, fundir 50g de gelo, restando ainda 150g de gelo remanescente.
ALTERNATIVA CORRETA: LETRA D
Questão 1513
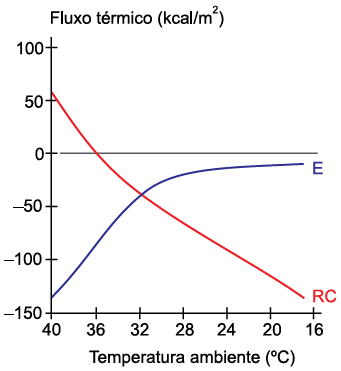
(Eduardo A. C. Garcia. Biofísica, 1997. Adaptado.)
Sabendo que os valores positivos indicam calor recebido pelo corpo e os valores negativos indicam o calor perdido pelo corpo, conclui-se que:
- A) em temperaturas entre 36 ºC e 40 ºC, o corpo recebe mais calor do ambiente do que perde.
- B) à temperatura de 20 ºC, a perda de calor por evaporação é maior que por radiação e convecção.
- C) a maior perda de calor ocorre à temperatura de 32 ºC.
- D) a perda de calor por evaporação se aproxima de zero para temperaturas inferiores a 20 ºC.
- E) à temperatura de 36 ºC, não há fluxo de calor entre o corpo e o meio.
Resposta: A alternativa correta é D) a perda de calor por evaporação se aproxima de zero para temperaturas inferiores a 20°C.
Explicação: Analisando o gráfico, podemos observar que a linha azul, que representa o calor trocado com o meio por evaporação (E), apresenta valores negativos para temperaturas inferiores a 20°C. Isso significa que, nessa faixa de temperatura, o corpo perde calor por evaporação. No entanto, quanto mais baixa a temperatura, menor é a perda de calor por evaporação. Portanto, para temperaturas próximas a 20°C, a perda de calor por evaporação se aproxima de zero.
Além disso, é importante notar que a linha vermelha, que representa o calor trocado com o meio por radiação e convecção (RC), apresenta valores positivos para temperaturas inferiores a 20°C. Isso significa que, nessa faixa de temperatura, o corpo recebe calor do meio ambiente.
Portanto, considerando os dados do gráfico, podemos concluir que a perda de calor por evaporação se aproxima de zero para temperaturas inferiores a 20°C, o que é a alternativa correta D.
1514) A água no estado líquido possui inúmeras características particulares, sendo uma delas a necessidade de maiores trocas de calor para se aquecer ou resfriar. Em regiões desérticas, onde a água é escassa, observamos grandes oscilações de temperatura com dias muito quentes e noites muito frias. Quanto ao exposto, considere as seguintes afirmações: (Dado: cágua=1 cal/g.ºC).
- A) I e II apenas.
- B) I, II e III.
- C) II apenas.
- D) II e III apenas.
A alternativa correta é letra B) I, II e III.
Gabarito: LETRA B.
I) Pelo fato de a água apresentar elevado valor de seu calor específico, as regiões litorâneas, insulares e lacustres, em que a água é abundante, a temperatura ambiente não costuma sofrer variações acentuadas. CORRETA.
De fato, a água apresenta um calor específico muito alto, podendo ser considerada um excelente elemento termorregulador. Assim, essas regiões apresentam baixa amplitude térmica, ou seja, pouca diferença entre a temperatura máxima e a mínima em um mesmo dia. Pois a quantidade de calor necessária para aquecer a água é elevada. Afirmativa correta.
II) Quanto maior o calor específico, maior a quantidade de calor necessária para variar a temperatura da substância. CORRETA.
O calor específico representa a quantidade de calor necessária para cada grama de uma determinadasubstância fazer variar 1ºC em sua temperatura. Dessa forma, quanto maior o calor específico, maior a quantidade de calor necessária para variar a temperatura da substância. Afirmativa correta.
III) O calor específico de cada substância depende de seu estado físico. CORRETA.
O calor específico é uma propriedade intrínseca à matéria, ou seja, depende de sua natureza. Dessa forma, um mesmo material apresenta diferentes valores de calor específicos para cada tipo de estado físico. Afirmativa correta.
Portanto, a resposta correta é a alternativa (b).
1515) Um painel coletor de energia solar é utilizado para aquecer a água de uma residência e todo o sistema tem um rendimento de 60%. Para aumentar a temperatura em 12,0 ºC de uma massa de água de 1000 kg, a energia solar total coletada no painel deve ser de
- A) 2,8 · 104 J
- B) 4,8 · 104 J
- C) 8,0 · 104 J
- D) 4,8 · 107 J
- E) 8,0 · 107 J
A alternativa correta é letra E) 8,0 · 107 J
Pessoal, em questões assim vejo alguns alunos tentar fazer o rendimento já com o cálculo de energia e cometer erros.
Para evitar, calcule inicialmente como se tivéssemos 100% de eficiência (observem que o calor específico está em gramas).
Q = m c Delta T
Q = 1.000 times 10^3 times 4 times 12
Q = 48 times 10^6 , J
Esse valor entretanto, equivale a um sistema 100% eficiente. Para um sistema menos, precisaremos de mais energia correto?
Logo, dividimos pelo rendimento fornecido. Vejo as vezes alunos multiplicando por 0,6 e obtendo um resultado errado.
Q_{REAL} = dfrac{48}{0,6} times 10^6 = 8,0 times 10^7 , J
Gabarito: LETRA E.
1516) Julgue o item a seguir com relação aos aspectos das ondas eletromagnéticas, da luz, da óptica e dos problemas da visão.
- A) Certo
- B) Errado
A resposta certa é A) Certo.
Para entender por quê, vamos mergulhar no mundo das ondas eletromagnéticas e da luz. As ondas eletromagnéticas são uma forma de radiação que se propaga pelo espaço em forma de campos elétricos e magnéticos oscilantes.
$$E = E_0 cos(kx - omega t)$$
onde $E$ é a amplitude do campo elétrico, $E_0$ é a amplitude máxima, $k$ é o número de onda, $x$ é a posição, $omega$ é a frequência angular e $t$ é o tempo.
Já a luz visível é uma forma de radiação eletromagnética que se encontra dentro do espectro eletromagnético, mais especificamente entre 400 nm e 700 nm.
Portanto, a luz visível é uma forma de radiação eletromagnética, o que torna a afirmação da questão verdadeira.
Essa é a razão pela qual a resposta certa é A) Certo.
1517) Um professor encontrou um termômetro com uma nomenclatura X. No manual de instruções, o professor verificou que a escala termométrica do termômetro possui as seguintes convenções: ponto de gelo 30ºX e ponto de vapor, 80ºX.
- A) Certo
- B) Errado
A alternativa correta é B) Errado.
Vamos analisar a situação: temos um termômetro com uma escala termométrica que tem como ponto de gelo 30°C X e ponto de vapor 80°C X. Para converter a temperatura medida na escala X (tX) para a escala Celsius (tC), a equação de conversão pode ser escrita como tX = 2 × tC + 30.
No entanto, essa equação não está correta. Para encontrar a equação de conversão correta, precisamos usar as informações dadas sobre a escala X.
Como o ponto de gelo é de 30°C X, podemos escrever uma equação para relacionar a temperatura em Celsius (tC) com a temperatura na escala X (tX): tC = 0°C quando tX = 30°C X.
Além disso, como o ponto de vapor é de 80°C X, podemos escrever outra equação: tC = 100°C quando tX = 80°C X.
Usando essas duas equações, podemos encontrar a equação de conversão correta. Primeiramente, podemos encontrar a diferença entre as temperaturas em Celsius entre os pontos de gelo e vapor: ΔtC = 100°C - 0°C = 100°C.
Em seguida, podemos encontrar a diferença entre as temperaturas na escala X entre os pontos de gelo e vapor: ΔtX = 80°C X - 30°C X = 50°C X.
Agora, podemos encontrar a razão entre as diferenças de temperatura: ΔtC / ΔtX = 100°C / 50°C X = 2°C / °C X.
Finalmente, podemos escrever a equação de conversão correta: tC = (tX - 30°C X) × (2°C / °C X) + 0°C.
Portanto, a resposta certa é B) Errado, pois a equação de conversão dada não é correta.
1518) Em um calorímetro de capacidade térmica desprezível, foi misturado 1 kg de água a 40 °C e 500 g de gelo a -10 °C. Após o equilíbrio térmico, a massa de água, em gramas, encontrada no calorímetro foi de: (Dados: calor específico da água = 1,0 cal/g°C; calor específico do gelo = 0,55 cal/g.°C; calor latente de fusão do gelo = 80,0 cal/g.)
- A) Zero
- B) 645
- C) 1000
- D) 1221
- E) 1466
A alternativa correta é letra E) 1466
Gabarito: LETRA E.
Primeiro, vamos calcular a quantidade de calor necessária para aquecer 500 g de gelo de -10°C a 0°C:
Q_1 = m_{gelo} cdot c_{gelo} cdot Delta theta_{gelo}
Q_1 = 500 cdot 0,55 cdot 10
Q_1 = 2.750 , cal
Como essa quantidade de calor é cedida pela variação da temperatura da água, vamos calcular a quantidade de calor cedida máxima, ou seja, quando 1 kg de água resfria de 40°C a 0°C:
Q_{max} = m_{água} cdot c_{água} cdot Delta theta_{água_{max}}
Q_{max} = 1000 cdot 1,0 cdot 40
Q_{max} = 40.000 , cal
Logo, a quantidade de calor que sobra para fundir o gelo é dada por
Q_{res} = Q_{max} - Q_1
Q_{res} = 40.000 - 2.750
Q_{res} = 37.250 , cal
Agora, vamos calcular a massa de gelo que pode ser fundida com essa quantidade de calor:
Q_{res} = m_{fundida} cdot L_{gelo}
37.250 = m_{fundida} cdot 80
m_{fundida} approx 465,6 , g
Então, a massa total de água encontrada no calorímetro é dada por:
m_{total} = m_{água_{inicial}} + m_{fundida}
m_{total} = 1.000 + 465,6
m_{total} approx 1.466 , g
Portanto, a resposta correta é a alternativa (e)
1519) Um gás ideal sofre uma expansão isotérmica, seguida de uma compressão adiabática. A variação total da energia interna do gás poderia ser nula se, dentre as opções abaixo, a transformação seguinte fosse uma
- A) compressão isocórica
- B) expansão isocórica
- C) expansão isobárica
- D) compressão isobárica
- E) compressão isotérmica
A alternativa correta é letra D) compressão isobárica
Gabarito: LETRA D.
Como o enunciado menciona, o gás ideal sofre primeiro uma expansão isotérmica. Em um diagrama PxV, essa transformação poderia ter o seguinte formato:
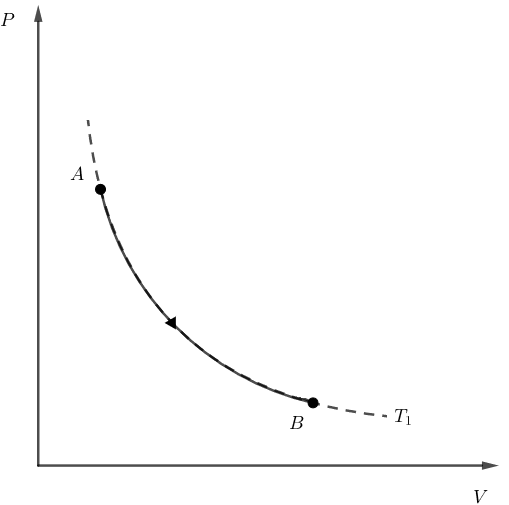
Ou seja, o processo A rightarrow B ocorre sobre uma isoterma.
Em seguida, o gás sofre uma compressão adiabática. Lembrando que, em uma compressão adiabática, ocorre uma diminuição de volume sem troca de calor, ou seja, Q = 0, então, de acordo com a primeira lei da termodinâmica, temos que:
Delta U_{B rightarrow C} = Q_{B rightarrow C} - W_{B rightarrow C}
Delta U_{B rightarrow C} = 0 - W_{B rightarrow C}
Delta U_{B rightarrow C} = - W_{B rightarrow C}
Como o gás sofre uma compressão, temos que W_{B rightarrow C} lt 0. Então, da equação acima, temos que Delta U_{B rightarrow C} gt 0, ou seja, a temperatura do gás aumenta, pois sabemos que Delta U = propto Delta T.
Assim, o diagrama PxV poderia ter o seguinte formato:
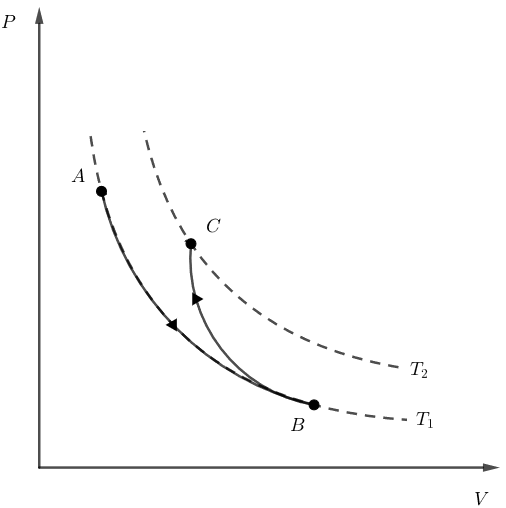
Agora, note que, para que a variação total da energia interna do gás seja nula, é necessário que o gás retorne ao ponto inicial, pois a energia interna é uma variável de estado, ou seja, o cálculo de sua variação depende apenas dos pontos inicial e final.
Assim, vamos analisar cada uma das alternativas:
a) compressão isocórica INCORRETA.
Em uma transformação isocórica, não há variação de volume. Logo, uma compressão (diminuição de volume) não é isocórica. Alternativa incorreta.
b) expansão isocórica INCORRETA.
Em uma transformação de expansão, há aumento de volume. Logo, essa transformação não é isocórica. Alternativa incorreta.
c) expansão isobárica INCORRETA.
Em uma transformação isobárica, não há variação de pressão. Assim, deveríamos ter P_A = P_C. Em um diagrama PxV, esse caso teria o seguinte formato:
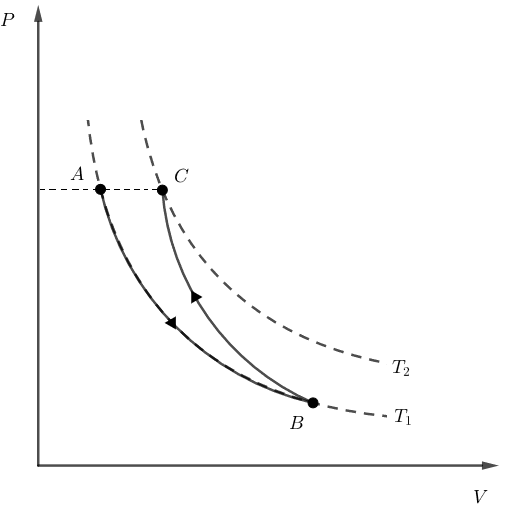
Note que, para que volte ao estado inicial A, o gás deveria sofrer uma compressão isobárica, e não uma expansão. Alternativa incorreta.
d) compressão isobárica CORRETA.
Como vimos na alternativa anterior, ao sofrer uma compressão isobárica, o gás poderia retornar para o estado inicial, como nos mostra o diagrama a seguir:
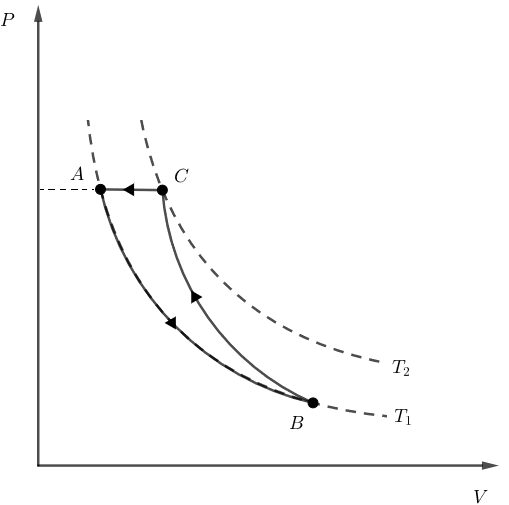
Assim, não haveria variação da energia interna total do gás. Logo, a alternativa está correta.
e) compressão isotérmica INCORRETA.
Como o gás deve retornar à temperatura inicial, ou seja, deve haver uma diminuição de temperatura, a transformação não pode ser isotérmica. Alternativa incorreta.
Portanto, a resposta correta é a alternativa (d).
Questão 1520
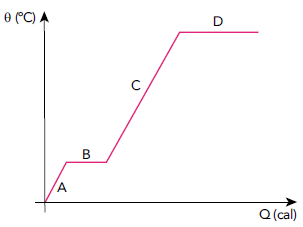
Durante a etapa D, ocorre a seguinte mudança de estado físico:
- A) fusão
- B) sublimação
- C) condensação
- D) vaporização
A alternativa correta é letra D) vaporização
Olhando a tabela abaixo para entender o que acontece em cada momento:
| A | aquecimento do sólido |
| B | fusão |
| C | aquecimento do líquido |
| D | vaporização |
Gabarito: LETRA D.
