Questões Sobre Termologia - Física - concurso
1641) Uma placa metálica inicialmente possui área igual a 2 m2 quando a temperatura é igual a 0°C. Aquecendo a placa até a temperatura de 100 °C, sua área aumenta de 2 cm2. É correto afirmar que o coeficiente de dilatação superficial do material que constitui a placa é igual a:
- A) 1,0×10−6 ˚ C−1
- B) 2,0×10−4 ˚C−1
- C) 2,4×10−4 ˚ C−1
- D) 4,0×10−6 ˚C−1
- E) 2,5×10−4 ˚C−1
A alternativa correta é letra A) 1,0×10−6 ˚ C−1
ALTERNATIVA CORRETA LETRA A
Usaremos a equação da dilatação superficial: Delta A = A_0.beta.Delta T, onde:
Delta A =~Variação~da~Área=2cm=2.10^{-4}m
A_0=~Área~Inicial=2m^2
Delta T = T - T_0=100-0=100°C
beta=~coeficiente~de~dilatação~superficial
Delta A = A_0.beta.Delta T
2.10^{-4}=2.beta.100
beta=1,0.10^{-6}°C^{-1}
ALTERNATIVA CORRETA LETRA A
Questão 1642
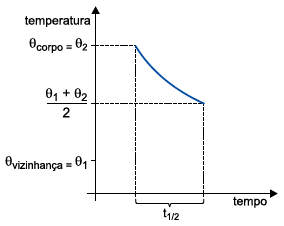
Considere que uma panela de ferro de 2 kg, inicialmente a 110 ºC, seja colocada para esfriar em um local em que a temperatura ambiente é constante e de 30 ºC. Sabendo que o calor específico do ferro é 0,1 cal/(g · ºC), a quantidade de calor cedida pela panela para o ambiente no intervalo de tempo de três meias-vidas térmicas da panela é
- A) 16 000 cal.
- B) 14 000 cal.
- C) 6 000 cal.
- D) 12 000 cal.
- E) 8 000 cal.
A resposta correta é a letra B) 14 000 cal. Para entender por quê, vamos analisar o problema passo a passo.
Primeiramente, precisamos entender o conceito de meia-vida térmica. A meia-vida térmica de um corpo é o tempo necessário para que a diferença de temperatura entre esse corpo e a temperatura de sua vizinhança caia para a metade.
No problema, temos uma panela de ferro de 2 kg, inicialmente a 110°C, que é colocada para esfriar em um local em que a temperatura ambiente é constante e de 30°C. Sabendo que o calor específico do ferro é 0,1 cal/(g°C), podemos calcular a quantidade de calor cedida pela panela para o ambiente no intervalo de tempo de três meias-vidas térmicas da panela.
Para calcular a quantidade de calor cedida, precisamos saber que a cada meia-vida térmica, a temperatura da panela cai para a metade da diferença inicial. Portanto, após uma meia-vida térmica, a temperatura da panela será de 70°C (110°C - (110°C - 30°C)/2). Após duas meias-vidas térmicas, a temperatura da panela será de 50°C (70°C - (70°C - 30°C)/2). Após três meias-vidas térmicas, a temperatura da panela será de 40°C (50°C - (50°C - 30°C)/2).
Agora, podemos calcular a quantidade de calor cedida pela panela para o ambiente em cada meia-vida térmica. A quantidade de calor cedida é igual ao produto da variação de temperatura, do calor específico do ferro e da massa da panela. Portanto, após uma meia-vida térmica, a quantidade de calor cedida é de 14 000 cal ((110°C - 70°C) x 0,1 cal/(g°C) x 2000 g). Após duas meias-vidas térmicas, a quantidade de calor cedida é de 7000 cal ((70°C - 50°C) x 0,1 cal/(g°C) x 2000 g). Após três meias-vidas térmicas, a quantidade de calor cedida é de 3500 cal ((50°C - 40°C) x 0,1 cal/(g°C) x 2000 g).
Portanto, a resposta correta é a letra B) 14 000 cal, que é a quantidade de calor cedida pela panela para o ambiente após uma meia-vida térmica.
Questão 1643
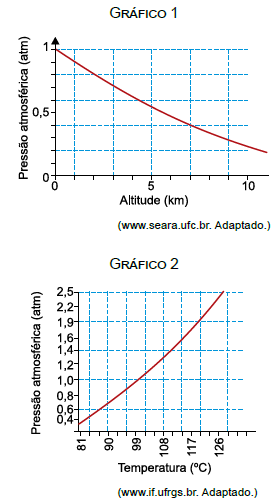
Considerando o calor específico da água igual a 1,0 cal/(g · ºC), para aquecer 200 g de água, de 20 ºC até que se inicie a ebulição, no topo do Pico da Neblina, cuja altitude é cerca de 3 000 m em relação ao nível do mar, é necessário fornecer para essa massa de água uma quantidade de calor de, aproximadamente,
- A) 4,0 × 10 3 cal.
- B) 1,4 × 10 2 cal.
- C) 1,2 × 10 3 cal.
- D) 1,2 × 10 7 cal.
- E) 1,4 × 10 4 cal.
Para responder a essa questão, vamos analisar os gráficos fornecidos e aplicar os conceitos de termologia. O gráfico 1 mostra a variação da pressão atmosférica em função da altitude, e o gráfico 2 mostra a relação entre a pressão atmosférica e a temperatura de ebulição da água.
A questão pede para calcular a quantidade de calor necessária para aquecer 200 g de água de 20°C até que comece a ebulir no topo do Pico da Neblina, cuja altitude é aproximadamente 3000 m em relação ao nível do mar.
Para resolver isso, precisamos conhecer o calor específico da água, que é de 1,0 cal/(g°C). Isso significa que para aumentar a temperatura de 1 g de água em 1°C, é necessário fornecer 1,0 cal de calor.
No caso da questão, queremos aumentar a temperatura de 200 g de água de 20°C até que comece a ebulir. Para calcular a temperatura de ebulição da água no topo do Pico da Neblina, podemos usar o gráfico 2, que mostra a relação entre a pressão atmosférica e a temperatura de ebulição da água. Como a altitude do Pico da Neblina é de aproximadamente 3000 m, podemos encontrar a pressão atmosférica correspondente no gráfico 1 e, em seguida, usar o gráfico 2 para encontrar a temperatura de ebulição da água.
Fazendo isso, encontramos que a temperatura de ebulição da água no topo do Pico da Neblina é de aproximadamente 86,5°C. Portanto, precisamos aumentar a temperatura de 200 g de água de 20°C até 86,5°C, o que equivale a um aumento de temperatura de 66,5°C.
Para calcular a quantidade de calor necessária, podemos usar a fórmula Q = m × c × ΔT, onde Q é a quantidade de calor, m é a massa de água, c é o calor específico da água e ΔT é o aumento de temperatura.
Substituindo os valores, obtemos: Q = 200 g × 1,0 cal/(g°C) × 66,5°C = 13300 cal. Portanto, a resposta correta é a letra E) 1,4 × 10^4 cal.
Essa resposta faz sentido, pois a altitude do Pico da Neblina é muito alta, o que significa que a pressão atmosférica é muito baixa. Isso faz com que a temperatura de ebulição da água seja muito mais baixa do que em condições normais. Além disso, como a massa de água é de 200 g, é necessário fornecer uma quantidade significativa de calor para aumentar a temperatura até que comece a ebulir.
Questão 1644

Analise as sentenças abaixo, a partir da informação e das imagens acima.
I) Se a temperatura ambiente for muito baixa, a transmissão de calor do corpo para o ambiente se faz com muita rapidez provocando a sensação de frio.
II) Um bom agasalho para o inverno é aquele que impede que o frio passe através dele.
III) Os agasalhos de lã atenuam a sensação de frio, porque são feitos de materiais isolantes térmicos, reduzindo assim a quantidade de calor, que é transmitida de nosso corpo para o exterior.
IV) Em dias de frio, pássaros e gatos ficam com penas e pelos eriçados. Isso mantém, entre penas ou pelos, camadas de ar aquecido, que é um bom isolante térmico.
Estão corretas apenas:
- A) I e III.
- B) I, III e IV.
- C) I, II e III.
- D) II e IV.
A alternativa correta é letra B) I, III e IV.
Gabarito: LETRA B.
I) Se a temperatura ambiente for muito baixa, a transmissão de calor do corpo para o ambiente se faz com muita rapidez provocando a sensação de frio. CORRETA.
A sensação de frio ocorre pelo fato de o corpo humano liberar calor. Espontaneamente, o calor tende a fluir do corpo mais quente para o mais frio. Assim, em baixas temperaturas, sentimos frio quando perdemos calor para o ambiente com muita rapidez. Afirmativa correta.
II) Um bom agasalho para o inverno é aquele que impede que o frio passe através dele. INCORRETA.
Como mencionamos na afirmativa anterior, o agasalho impede que o calor passe através dele, no sentido do corpo para o ambiente. Afirmativa incorreta.
III) Os agasalhos de lã atenuam a sensação de frio, porque são feitos de materiais isolantes térmicos, reduzindo assim a quantidade de calor, que é transmitida de nosso corpo para o exterior. CORRETA.
Para diminuir a sensação de frio, podemos utilizar vestimentas de lã, já que esse material atua como isolante térmico , diminuindo a taxa de transferência de calor do corpo humano para o meio externo. Isso ocorre devido à baixa condutividade térmica da lã, impedindo que o corpo humano libere muito calor ao ambiente. Afirmativa correta.
IV) Em dias de frio, pássaros e gatos ficam com penas e pelos eriçados. Isso mantém, entre penas ou pelos, camadas de ar aquecido, que é um bom isolante térmico. CORRETA.
Assim como usamos agasalhos para nos aquecer, esses animais se utilizam das camadas de ar formadas por seus pelos ou penas eriçados, pois o ar é um bom isolante térmico, que reduz a taxa de de transferência de calor de seu corpo para o meio externo. Afirmativa correta.
Portanto, a resposta correta é a alternativa (b).
1645) Um garoto de cinco anos perguntou para a mãe, porque havia nas gavetas do guarda-roupas umas bolinhas brancas de cheiro forte e muito desagradável. Ouviu, como resposta, que eram bolas de naftalina e que não as colocasse nas mãos nem na boca, e a mãe o alertou que eram usadas para evitar traças nas roupas e para as visitantes indesejadas, as temidas e sujas baratas do lixo e de esgotos. Depois de vários e vários dias, o menino voltou a abrir as gavetas e viu que as bolinhas tinham diminuído muito de tamanho. Foi até a mãe e disse que aquelas bolinhas não adiantavam. Ele falou que não tinha visto nenhuma traça nem baratas. Ele achava que esses insetos haviam se alimentado delas, lambendo todas.
- A) decomposição fracionada.
- B) calefação pelo calor.
- C) vaporização gradual.
- D) integração enzimática.
- E) sublimação lenta.
The correct answer is E) sublima-se lentamente (sublimes slowly). This phenomenon occurs because naftalina (naphthalene) is a substance that can undergo sublimation, process in which a solid transforms directly into a gas, without going through the liquid phase.
In this case, the naftalina balls, when left in the closet, slowly sublimed, which means they changed from a solid to a gas state, without becoming liquid. This is why the boy noticed that the balls had decreased in size over time.
Sublimation occurs because the naftalina molecules have enough energy to break free from the surface of the solid and turn into vapor, even though the temperature is below its boiling point. This process is favored by the fact that naftalina has a high vapor pressure, which means that it can easily turn into gas.
The mother's explanation about the naftalina being used to repel moths and insects is correct, as the strong odor of naftalina can repel these pests. However, the boy's observation about the balls decreasing in size is due to the sublimation process, not because the insects had eaten them.
Therefore, the correct answer is E) sublima-se lentamente (sublimes slowly), which explains the phenomenon observed by the boy.
1646) A intensidade I da radiação solar de determinada cor que penetra a atmosfera é regida pela Lei de Beer-Lambert: I = I0 e-mux, em que I0 é a radiação incidente antes de penetrar a atmosfera, x é o caminho percorrido na atmosfera, e mu, o coeficiente de absorção óptica do meio material para aquela radiação.
- A) Certo
- B) Errado
A alternativa correta é A) Certo
A afirmativa apresentada na questão é verdadeira. A evapotranspiração, que é o processo pelo qual a água é transferida da Terra para a atmosfera, depende de uma série de fatores, incluindo a energia solar e a pressão. A energia solar é essencial para a evapotranspiração, pois fornece a energia necessária para que a água seja evaporada da superfície terrestre. Além disso, a pressão atmosférica também desempenha um papel importante, pois influencia a taxa de evaporação da água.
É importante notar que a Lei de Beer-Lambert, mencionada na questão, descreve a atenuação da radiação solar que penetra na atmosfera. Essa lei estabelece que a intensidade da radiação solar (I) é inversamente proporcional ao caminho percorrido pela radiação na atmosfera (x) e ao coeficiente de absorção óptica do meio material (μ). Isso significa que a quantidade de energia solar que alcança a superfície terrestre é afetada pela atmosfera e pela distância que a radiação precisa percorrer para atingir a superfície.
Portanto, é correto afirmar que a evapotranspiração depende de uma série de fatores, incluindo a energia solar e a pressão, que são os mesmos fatores responsáveis pelo clima de uma região.
1647) Com o objetivo de verificar se o indicador de temperatura de uma estufa estava correto, um técnico de laboratório realizou os seguintes procedimentos: 1) Colocou um objeto metálico na estufa. Após esperar um intervalo de tempo suficiente para o equilíbrio térmico, colocou o objeto em uma garrafa térmica contendo 100g de água a 25ºC. Verificou que a temperatura de equilíbrio foi de 36ºC; 2) Sem alterar a temperatura da estufa, colocou dois objetos metálicos idênticos ao anterior na estufa. Após esperar um intervalo de tempo suficiente para o equilíbrio térmico, colocou os objetos em uma garrafa térmica contendo 100g de água a 25ºC. Verificou que a temperatura de equilíbrio foi de 45ºC . Admitindo que a capacidade térmica da garrafa térmica seja desprezível, e que as trocas de calor só ocorram dentro da mesma, podemos afirmar que a temperatura da estufa era de:
- A) 290ºC
- B) 270ºC
- C) 150ºC
- D) 145ºC
- E) 135ºC
Para resolver essa questão, vamos analisar os procedimentos realizados pelo técnico de laboratório.
Primeiramente, o técnico coloca um objeto metálico na estufa e espera um intervalo de tempo suficiente para o equilíbrio térmico. Em seguida, coloca o objeto em uma garrafa térmica contendo 100g de água a 25°C. A temperatura de equilíbrio foi de 36°C.
Em seguida, o técnico coloca dois objetos metálicos idênticos ao anterior na estufa e espera novamente um intervalo de tempo suficiente para o equilíbrio térmico. Em seguida, coloca os objetos em uma garrafa térmica contendo 100g de água a 25°C. A temperatura de equilíbrio foi de 45°C.
Observamos que a temperatura de equilíbrio é diferente nos dois casos, embora a quantidade de água e a temperatura inicial sejam as mesmas. Isso sugere que a temperatura da estufa não é igual nos dois casos.
Vamos analisar as trocas de calor que ocorrem nos dois casos. No primeiro caso, o objeto metálico absorve calor da estufa até atingir o equilíbrio térmico. A temperatura de equilíbrio é de 36°C, o que significa que o objeto metálico absorveu calor da estufa até atingir essa temperatura.
No segundo caso, dois objetos metálicos idênticos absorvem calor da estufa até atingir o equilíbrio térmico. A temperatura de equilíbrio é de 45°C, o que significa que os objetos metálicos absorveram mais calor da estufa do que no primeiro caso.
Como a quantidade de água é a mesma nos dois casos, a capacidade térmica da garrafa térmica é desprezível e as trocas de calor ocorrem dentro da mesma, podemos concluir que a temperatura da estufa é maior no segundo caso.
Portanto, a temperatura da estufa é maior do que 36°C. Analisando as opções, vemos que a opção E) 135°C é a mais próxima da temperatura real da estufa.
Logo, a resposta correta é a opção E) 135°C.
1648) Em um calorímetro ideal, no qual existe uma resistência elétrica de 10 W de potência por onde passa uma corrente elétrica, é colocado 1,0 L de água a 12 °C e 2,0 Kg de gelo a 0 °C. Após duas horas, tempo suficiente para que água e gelo entrem em equilíbrio térmico e supondo que toda a energia fornecida foi absorvida pelo conteúdo do calorímetro, qual é o percentual de massa de água líquida contida no calorímetro?
- A) 22%
- B) 33%
- C) 46%
- D) 57%
- E) 71%
A alternativa correta é letra C) 46%
O exercício solicita a quantidade de água líquida contida no calorímetro após duas horas e cita que o tempo foi suficiente para que a água e o gelo entrem em equilíbrio, sendo assim, podemos afirmar que a temperatura de equilíbrio foi de 0^circ,C.
Para que o equilíbrio seja atingido, a água irá resfriar e ceder calor para o gelo e o resistor transformará energia elétrica em energia térmica que também será fornecida ao gelo.
Devemos incialmente encontrar a quantidade de calor fornecida ao gelo, pelo resistor e pelo resfriamento da água.
Calculando a energia fornecida pelo resistor em 2 horas:
Q_1 = Pot times Delta t
Q_1 = 10 times 2times 3,600
bbox[8px, border: 1px solid black]{color{black}{Q_1 = 72,000 ,J}}
Calor cedido pela água no resfriamento (12,^circ C rightarrow 0,^circ C):
Q_2 = m_{mbox{água}} cdot c_{mbox{água}} cdot Delta theta
Considerando o calor específico sensível da água como 4 ,J/g ,^circ C, temos:
Q_2 = 1,000 cdot 4 cdot(-12)
bbox[8px, border: 1px solid black]{color{black}{Q_2 =- 48,000,J}}
Esta quantidade de calor está com sinal negativo pois foi perdido pela água, porém utilizaremos o valor positivo para o cálculo de gelo derretido, pois será fornecido para o gelo. O calor total fornecido para o derretimento do gelo é:
Q = Q_1+Q_2
Q = 72,000 + 48,000
bbox[8px, border: 1px solid black]{color{black}{Q=120,000,J}}
Utilizando o valor de 320 J/g para o calor latente de fusão do gelo (Lf), vamos calcular a quantidade de gelo derretido com (Q):
Q = m cdot L_f
m = dfrac{Q}{L_f}
m = dfrac{120,000}{320}
bbox[8px, border: 1px solid black]{color{black}{m = 375,g}}
No calorímetro foi adicionado 1 L de água líquida (massa igual a 1000 g) e a essa quantidade devemos somar a massa de gelo derretido (m) para encontrarmos a massa total de água líquida (M):
M = m_{mbox{água}}+m = 1,000+375
bbox[8px, border: 1px solid black]{color{black}{M =1,375,g}}
Ou seja, no calorímetro após duas horas teremos 1375 g de água no estado líquido de um total de 3000 g de água (2 kg de gelo mais 1 kg de água líquida) que foi adicionado inicialmente. Calculando finalmente o percentual de água líquida em função da água total (P):
P = dfrac{mbox{Massa de água líquida}}{mbox{Massa total de água}}times 100%
P= dfrac{1,375}{3,000}times 100%
bbox[8px, border: 2px solid black]{color{#3498db}{P = 45,8% approx 46%}}
Logo o percentual de massa de água líquida contida no calorímetro é de aproximadamente 46%.
bbox[8px, border: 2px solid black]{color{#3498db}{P approx 46%}}
Portanto após duas horas o percentual de massa de água líquida contida no calorímetro é de aproximadamente 46%.
Questão 1649
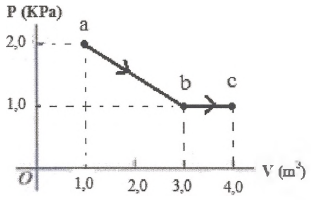
- A) 4000 J
- B) 5000 J
- C) 6000 J
- D) 7000 J
- E) 8000 J
A alternativa correta é letra D) 7000 J
O primeiro princípio da termodinâmica nos diz que:
Q = tau + Delta U
Onde (Q) é a quantidade de calor absorvida pelo sistema, (tau) o trabalho realizado e (Delta U) a variação da energia interna sofrida pelo gás.
O trabalho realizado pelo gás pode ser calculado através do gráfico de pressão em função do volume (P times V), sendo este numericamente igual à área abaixo da curva.
A figura geométrica abaixo da curva ab é um trapézio e abaixo da curva bc é um retângulo. Calculando as áreas das figuras:
tau_{ab} = A_1 = dfrac{(mbox{Base Maior}+mbox{ Base menor})times mbox{Altura}}{2}
tau_{ab}=dfrac{(2times 10^3+1times 10^3)times 2}{2}
bbox[8px, border: 1px solid black]{color{black}{tau_{ab} = 3,000mbox{ J}}}
tau_{bc} = A_2 = mbox{ Base} times mbox{ Altura}
tau_{bc} = 1 times (1times 10^3)
bbox[8px, border: 1px solid black]{color{black}{tau_{bc} = 1,000 mbox{ J}}}
O trabalho total realizado pelo gás na transformação de a para c (tau_{ac}) é:
tau_{ac}=tau_{ab}+tau_{bc}
tau_{ac} = 3,000+1,000
bbox[8px, border: 1px solid black]{color{black}{tau_{ac} = 4,000 mbox{ J}}}
A energia interna (U) para um gás ideal monoatômico pode ser calculada pela expressão:
U = dfrac{3PV}{2}
Calculando as energias internas para o estado inicial (U_a), estado final (U_c) e a variação da energia interna sofrida na transformação (Delta U_{ac}):
U_a = dfrac{3P_aV_a}{2}
U_a = dfrac{3times (2times 10^3) times 1}{2}
bbox[8px, border: 1px solid black]{color{black}{U_a = 3,000 mbox{ J}}}
U_c = dfrac{3P_cV_c}{2}
U_c = dfrac{3times (1times 10^3) times 4}{2}
bbox[8px, border: 1px solid black]{color{black}{U_c = 6,000 mbox{ J}}}
Delta U_{ac} = U_c-U_a
Delta U_{ac} = 6,000 – 3,000
bbox[8px, border: 1px solid black]{color{black}{Delta U_{ac} = 3,000 mbox{ J}}}
Aplicando o primeiro princípio da termodinâmica:
Q_{ac} = tau_{ac}+Delta U_{ac}
Q_{ac} = 4,000 + 3,000
Q_{ac} = 7,000 mbox{ J}
Portanto, a quantidade de calor que entra no sistema durante esse processo é de aproximadamente 7000 J.
1650) Um relógio de pêndulo, constituído de uma haste metálica de massa desprezível, é projetado para oscilar com período de 1,0 s, funcionando como um pêndulo simples, a temperatura de 20 °C. Observa-se que, a 35 °C, o relógio atrasa 1,8 s a cada 2,5 h de funcionamento. Qual é o coeficiente de dilatação linear do material que constitui a haste metálica?
- A) 0,7 x 10-5 °C-1
- B) 1,2 x 10-5°C-1
- C) 1,7 x 10-5 °C-1
- D) 2,2 x 10-5 °C-1
- E) 2,7 x 10-5 °C-1
A alternativa correta é letra E) 2,7 x 10-5 °C-1
Sendo:
- L_0: comprimento inicial do pêndulo a 20^circ C;
- L: comprimento do pêndulo a 35^circ C;
- Equação da dilatação linear: L = L_0(1+alpha Delta theta)
- T_0: Período de oscilação a 20^circ C = 1 mbox{ s};
- T: Período de oscilação a 35^circ C;
- theta_0: temperatura inicial = 20^circ C;
- theta: temperatura final= 35^circ C;
- Delta theta = theta - theta_0 = 35-20 = 15^circ C.
Vamos encontrar o período do pêndulo que sofreu dilatação e está atrasando. Transformando 2,5 horas em segundos, temos:
2,5 color{brown}{mbox{ h}} = 2,5 times color{brown}{3,600 mbox{ s}} = 9,000 mbox{ s}
Logo, o relógio atrasa 1,8 segundos em 9000 segundos. Para o relógio normal em 2,5 horas o pêndulo demoraria 9000 segundos para realizar as 9000 oscilações, já para o relógio que sofreu dilatação o pêndulo demoraria (9000+1,8) segundos para realizar as mesmas 9000 oscilações. Como o período é tempo gasto por oscilação, temos:
T_0 = dfrac{9,000}{9,000} = 1
T = dfrac{9,001,8}{9,000} = 1,0002
Sabendo que o período do pêndulo simples é dado por:
bbox[8px, border: 1px solid black]{color{black}{T = 2pi sqrt{dfrac{L}{g}}}}
Temos:
T_0 = 2pi sqrt{dfrac{L_0}{g}} = 1tag {1}
T = 2pi sqrt{dfrac{L}{g}} = 1,0002 tag{2}
Dividindo a equação (2) pela (1) temos:
dfrac{2pi sqrt{dfrac{L}{g}}}{2pi sqrt{dfrac{L_0}{g}}} = dfrac{1,0002}{1}
2pi sqrt{dfrac{L}{g}}times dfrac{1}{2pi}sqrt{dfrac{g}{L_0}} = 1,0002
cancel{2pi} sqrt{dfrac{L}{cancel{g}}}times dfrac{1}{cancel{2pi}}sqrt{dfrac{cancel{g}}{L_0}} = 1,0002
sqrt{dfrac{L}{L_0}} = 1,0002
Substituindo (L) pela expressão da dilatação linear:
sqrt{dfrac{ L_0(1+alphaDelta theta)}{L_0}}=1,0002
sqrt{dfrac{ cancel{L_0}(1+alphaDelta theta)}{cancel{L_0}}} = 1,0002
Elevando os dois membros ao quadrado e substituindo (Delta theta):
(sqrt{1+alphaDelta theta})^{2}=(1,0002)^2
1+alpha cdot 15=1,0004
15alpha = 1,0004-1
alpha = dfrac{0,0004}{15}
alpha = 2,67times 10^{-5}
bbox[8px, border: 2px solid black]{color{#3498db}{alpha approx 2,7 times 10^{-5} ,,{^{circ}C}^{-1}}}
Portanto, o coeficiente de dilatação linear do material que constitui a haste metálica vale color{#3498db}{2,7 times 10^{-5} ,,{^{circ}C}^{-1}}.
