Questões Sobre Termologia - Física - concurso
171) Um cilindro, com pistão móvel sem atrito, contém 6,0 L de hidrogênio, à pressão de 1,0 atm e temperatura de 27 °C. O gás sofre uma transformação até que a pressão resulte 0,5 atm e a temperatura passe a 177 °C.
- A) 36.
- B) 18.
- C) 2,0.
- D) 3,0.
- E) 9,0.
Resposta: B) 18 L
Para resolver esse problema, precisamos aplicar a equação de estado dos gases ideais, que é:
Onde P é a pressão, V é o volume, n é a quantidade de substância (número de mols), R é a constante dos gases ideais e T é a temperatura em Kelvin.
No estado inicial, temos:
No estado final, temos:
Como a quantidade de substância (n) não muda, podemos igualar as duas equações de estado:
Isolando V_2, temos:
Portanto, o volume do gás no novo estado é de 18 L.
Explicação:
Nesse problema, estamos lidando com uma transformação de estado do gás, onde a pressão e a temperatura mudam. Para resolver, precisamos aplicar a equação de estado dos gases ideais, que nos permite relacionar as variáveis de estado do gás. No estado inicial, conhecemos a pressão, o volume e a temperatura, e no estado final, conhecemos a pressão e a temperatura. Podemos igualar as duas equações de estado e isolar o volume final, que é o que estamos procurando.
172) Um recipiente rígido contem 6,0 mols de um gás perfeito à temperatura de 127 °C e pressão P.
- A) 1,0.
- B) 2,0.
- C) 5,0.
- D) 4,0.
- E) 3,0.
A resposta certa é a alternativa B) 2,0.
Vamos entender o porquê. Temos um recipiente rígido contendo 6,0 mols de um gás perfeito à temperatura de 127°C e pressão P. Para que a pressão exercida pelo gás não se altere quando a sua temperatura sobe para 327°C, precisamos manter o produto PV constante, pois o gás é perfeito.
Para isso, vamos utilizar a equação de estado dos gases perfeitos, que é dada por:
$$PV = nRT$$Onde P é a pressão, V é o volume, n é o número de mols, R é a constante dos gases perfeitos e T é a temperatura em Kelvin.
Como o recipiente é rígido, o volume é constante. Além disso, a temperatura inicial é de 127°C, que é igual a 400 K. Substituindo esses valores na equação, temos:
$$P_1V = n_1RT_1 Rightarrow P_1V = 6,0R cdot 400$$Agora, quando a temperatura sobe para 327°C (ou 600 K), precisamos manter a pressão constante. Isso significa que:
$$P_2V = n_2RT_2 Rightarrow P_2V = n_2R cdot 600$$Como a pressão é constante, $P_1 = P_2$. Além disso, o volume também é constante, pois o recipiente é rígido. Portanto, podemos igualar as duas equações:
$$6,0R cdot 400 = n_2R cdot 600$$Dividindo ambos os lados pela constante R e pela temperatura final de 600 K, encontramos:
$$n_2 = frac{6,0 cdot 400}{600} = 4,0$$Isso significa que precisamos retirar 2,0 mols do gás do recipiente para que a pressão não se altere quando a temperatura sobe para 327°C. Portanto, a alternativa correta é a B) 2,0.
173) Um gás ideal encontra-se confinado em um recipiente fechado, cuja pressão é de 2,0 atm, a temperatura, de 27 ºC e o volume, de 1,0 litro.
- A) realiza um trabalho de 4,0 x 105 J.
- B) sofre um trabalho de 4,0 x 105 J.
- C) realiza um trabalho de 4,4 x 106 J.
- D) sofre um trabalho de 4,4 x 106 J.
ESTA QUESTÃO FOI ANULADA, NÃO POSSUI ALTERNATIVA CORRETA
De acordo com a lei geral dos gases, temos:
dfrac{P_1 V_1}{T_1} = dfrac{P_2 V_2}{T_2}
Mantendo a pressão constante, temos P_1 = P_2. Vamos substituir os valores do enunciado, lembrando que as unidades devem estar de acordo com a tabela a seguir:
| Pressão (P) | Volume (V) | Temperatura (T) |
|---|---|---|
| atm | L | K |
| Pa | m3 | K |
| mmHg | L | K |
Então, temos:
dfrac{ cancel{P_1} V_1}{T_1} = dfrac{ cancel{P_2} V_2}{T_2}
dfrac{1,0}{27+273} = dfrac{V_2}{627+273}
dfrac{1,0}{300} = dfrac{V_2}{900}
V_2 = 3,0 l
Quando o calor é fornecido ao sistema, o gás sofrerá uma expansão. O trabalho realizado por um sistema, em uma transformação a pressão constante, é dado pelo produto entre a pressão e a variação do volume do gás. Logo,
tau = P cdot Delta V
Para encontrar o trabalho em joules, precisamos utilizar a pressão em pascal e o volume em metros cúbicos. Como Delta V = V_2 - V_1 = 3,0 l - 1,0 l = 2,0 l = 0,002 m^3 temos:
tau = 2 cdot 10^5 cdot 0,002
tau = 400 J
Como não há alternativa com a resposta correta, a questão foi anulada.
174) Um resultado de grande importância para a Física foi obtido experimentalmente por Robert Boyle. A lei de Boyle, como ficou conhecida está melhor representada pela equação:
- A) PV=k (k constante)
- B) PV=lnV
- C) P/V=f(V)
- D) P=V²T
- E) PVT=(T-1)²
A resposta certa é a letra A) PV = k (k constante).
A lei de Boyle é uma equação que relaciona a pressão (P) e o volume (V) de um gás ideal, mantendo a temperatura constante. A equação PV = k, em que k é uma constante, indica que, para uma determinada temperatura, o produto da pressão pelo volume é constante.
Isso significa que, se aumentarmos a pressão do gás, o volume diminuirá proporcionalmente, e vice-versa. Essa lei é fundamental na termodinâmica e tem várias aplicações práticas em engenharia, física e química.
A lei de Boyle foi descoberta pelo físico irlandês Robert Boyle em 1662 e é considerada um dos principais resultados experimentais da física. Ela fornece uma relação simples e importante entre a pressão e o volume de um gás ideal.
Portanto, a resposta certa é a letra A) PV = k (k constante), que representa a lei de Boyle.
175) Em um cilindro hermeticamente fechado, há uma mistura de dois gases ideais, que chamaremos de A e B. A fração da pressão total exercida nas paredes do cilindro devida ao gás B é 0,4. Considerando que nessa mistura existem 6,0 mols do gás A, assinale a alternativa correta para o número de mols do gás B contido no cilindro.
- A) 5,0.
- B) 4,0.
- C) 3,0.
- D) 2,0.
- E) 1,0.
A alternativa correta é letra B) 4,0.
De acordo com a lei de Dalton, a pressão total da mistura de gases ideais é a soma das pressões parciais de cada componente da mistura. Assim, temos:
P_{total} = P_{A} + P_{B}
Do enunciado, temos que P_{B} = 0,4 P_{total}, logo P_{A} = 0,6 P_{total}
Além disso, de acordo com a lei geral dos gases ideais temos:
PV =nRT
Então,
P_{A} V = n_{A} RT
P_{A} = dfrac {n_{A} RT}{V}
Como P_{A} = 0,6 P_{total}, temos:
0,6 P_{total} = dfrac {6 RT}{V}
P_{total} = 10 dfrac {RT}{V}
Logo,
P_{A} +P_{B} = dfrac {n_{a} RT}{V} + dfrac {n_{B} RT}{V}
P_{A} +P_{B} = dfrac {left( n_{A} + n_{B} right) RT}{V}
left( P_{A} +P_{B} right) V = left( n_{A} + n_{B} right) RT
P_{total} V = left( n_{A} + n_{B} right) RT
Substituindo-se P_{total} = 10 dfrac {RT}{V}, temos:
10 dfrac { cancel {RT}}{cancel V} cancel V = left( n_{A} + n_{B} right) cancel {RT}
left( n_{A} + n_{B} right) = 10
left( 6 + n_{B} right) = 10
n_{B} = 4
Portanto, a resposta correta é a alternativa (B).
176) A respeito dos processos termodinâmicos a seguir, assinale V para a afirmativa verdadeira e F para a falsa.
- A) F, V e V.
- B) V, F e V.
- C) V, V e F.
- D) V, F e F.
- E) F, F e F.
Resposta: A) F, V e V.
Explicação:
Para responder à questão, vamos analisar cada uma das afirmações:
(1) Em um processo adiabático de um gás ideal, a temperatura do gás não se conserva constante. Isso porque, sem troca de calor, pode ocorrer variação de temperatura. Portanto, essa afirmação é Falsa (F).
(2) Quando uma massa de um gás ideal evolui entre dois estados de equilíbrio termodinâmico, tanto o trabalho W realizado pelo gás quanto a quantidade de calor Q recebida pelo gás dependem do processo pelo qual se deu a evolução entre os estados inicial e final de equilíbrio. No entanto, a diferença Q - W não é sempre a mesma, seja qual for o processo entre esses mesmos estados inicial e final. Portanto, essa afirmação é Verdadeira (V).
(3) Para que a temperatura de uma massa de um gás ideal sofra um acréscimo ΔT, cedendo-lhe calor, devemos aquecer o gás mantendo seu volume constante. Isso não é verdadeiro. Para que a quantidade de calor cedida seja a menor possível, devemos aquecer o gás de forma isobárica (manter a pressão constante), e não isocórica (manter o volume constante). Portanto, essa afirmação é Falsa (F).
Portanto, as respostas são F, V e V, respectivamente.
177) Se se mantiver uma abertura estreita em nossa boca e se assoprar com vigor a mão, o ar expelido sofre uma violenta expansão por meio de uma transformação adiabática, na qual
- A) o trabalho realizado correspondeu à diminuição da energia interna desse ar, por não ocorrer troca de calor com o meio externo.
- B) o trabalho realizado correspondeu ao aumento da energia interna desse ar, por não ocorrer troca de calor com o meio externo.
- C) o trabalho realizado correspondeu ao aumento da quantidade de calor trocado por esse ar com o meio, por não ocorrer variação da sua energia interna.
- D) não houve realização de trabalho, uma vez que o ar não absorveu calor do meio e não sofreu variação de energia interna.
- E) não houve realização de trabalho, uma vez que o ar não cedeu calor para o meio e não sofreu variação de energia interna.
A alternativa correta é letra A) o trabalho realizado correspondeu à diminuição da energia interna desse ar, por não ocorrer troca de calor com o meio externo.
De acordo com a primeira lei da termodinâmica, ao receber calor, um gás pode realizar trabalho e aumentar sua energia interna, o que pode ser matematicamente expresso da seguinte forma:
Q = W + Delta U
Onde Q é o calor recebido, W é o trabalho realizado pelo gás e Delta U é a variação da energia interna do gás.
Uma transformação adiabática consiste em um processo termodinâmico que ocorre sem trocas de calor. Assim, de acordo com a expressão acima, quando Q=0, temos que:
W = - Delta U
Ou seja, o trabalho realizado é igual ao negativo da variação da energia interna. Como o gás se expande, temos que W é positivo. Então, da equação acima, podemos afirmar que Delta U é negativo, ou seja, há uma diminuição de energia interna desse gás.
Portanto, a resposta correta é a alternativa (A).
178) Um gás ideal, de massa constante, sofre determinada transformação na qual a sua pressão duplica e o seu volume triplica. Com relação à temperatura absoluta do referido gás, é certo afirmar-se que
- A) cai para a metade.
- B) não muda.
- C) duplica.
- D) triplica.
- E) sextuplica.
A alternativa correta é letra E) sextuplica.
Sejam P_1, V_1 e T_1 a pressão, o volume e a temperatura iniciais do gás, respectivamente. Assim, se o gás sofre uma determinada transformação na qual a sua pressão duplica e o seu volume triplica, temos que T_2 = 2 T_1 e V_2 = 3 V_1. Assim, de acordo com a equação geral dos gases ideais, temos que:
dfrac { P_1 cdot V_1 }{ T_1 } = dfrac { P_2 cdot V_2 }{ T_2 }
Logo,
dfrac { cancel {P_1} cdot cancel{V_1} }{ T_1 } = dfrac { 2 cancel {P_1} cdot 3 cancel{V_1} }{ T_2 }
dfrac { 1 }{ T_1 } = dfrac { 6 }{ T_2 }
T_2 = 6 cdot T_1
Portanto, a resposta correta é a alternativa (E).
Questão 179
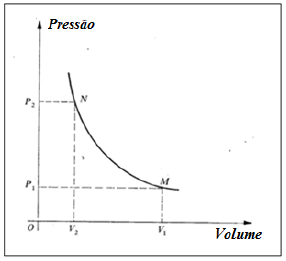
- A) o processo é adiabático.
- B) o trabalho é realizado sobre o gás.
- C) no processo a pressão se mantém constante.
- D) a temperatura do estado M é 300°C.
- E) a temperatura do processo é -243°C.
A alternativa correta é letra E) a temperatura do processo é -243°C.
A lei de Boyle estabelece que, em uma transformação isotérmica, a pressão e o volume de um gás ideal confinado são inversamente proporcionais, ou seja:
P_1 cdot V_1 = P_2 cdot V_2
Assim, vamos analisar cada uma das alternativas:
a) o processo é adiabático. INCORRETA.
Em um processo adiabático, não há troca de calor. Como gás ideal evolui do estado N para o estado M através de uma transformação isotérmica, pela primeira lei da termodinâmica (Delta U = Q - W), podemos afirmar que, se a temperatura não varia, a variação do volume do gás se deve ao calor absorvido. Logo, o processo não é adiabático. Alternativa incorreta.
b) o trabalho é realizado sobre o gás. INCORRETA.
Como o volume do estado M é maior do que o volume do estado N, o trabalho é realizado pelo gás, e não sobre ele. Alternativa incorreta.
c) no processo a pressão se mantém constante. INCORRETA.
Como podemos ver no gráfico, a pressão não é mantida constante. Alternativa incorreta.
d) a temperatura do estado M é 300°C. INCORRETA.
De acordo com a lei dos gases ideais, temos que:
PV = nRT
Logo,
T = dfrac { PV } { nR}
Então, para P_1 = 2,0 times 10^5 , Pa e V_1 = 1,245 times 10^{-3} , m^3, temos que:
T = dfrac { 2,0 times 10^5 cdot 1,245 times 10^{-3} } { 1 cdot 8,3 }
T = 30 , K = - 243 , °C
Alternativa incorreta.
e) a temperatura do processo é -243°C. CORRETA.
Alternativa correta. Vide comentário anterior.
Portanto, a resposta correta é a alternativa (E).
180) Considere que dois mols de um gás ideal monoatômico estão contidos em um dado recipiente que passa por uma transformação isobárica com pressão de 0,3 atm. Nessa transformação, sua temperatura é elevada de 300 para 600 K e seu volume sofre uma elevação de 300 litros.
- A) 7,5 × 10^3 J / 9,0 × 10^3 J / 1,6 × 10^4 J
- B) 7,5 × 10^3 J / 9,0 × 10^6 J / 9,0 × 10^6 J
- C) 6,2 × 10^4 J / 9,0 × 10^3 J / 7,1 × 10^4 J
- D) 6,2 × 10^4 J / 9,0 × 10^6 J / 9,0 × 10^6 J
A alternativa correta é letra A) 7,5 × 10^3 J / 9,0 × 10^3 J / 1,6 × 10^4 J
Para resolver essa questão, devemos lembrar que a energia interna gás monoatômico é dada por:
Delta U = dfrac 3 2 cdot n cdot R cdot Delta T
Onde n é o número de mols, R é a constante universal dos gases e Delta T é a variação da temperatura. Assim, substituindo-se os valores do enunciado, a variação da energia interna desse gás é dada por:
Delta U = dfrac 3 2 cdot 2 cdot 8,3 cdot (600 -300 )
Delta U = 7,47 times 10^{3} , J
O trabalho realizado por um gás à pressão constante P é dado por:
W = P cdot Delta V
Onde Delta V é a variação de volume. Lembrando que 1 , l = 1 times 10^{-3} , m^3 e que 1 , atm=1 × 10^5 , Pa, o trabalho realizado pelo gás para Delta V = 300 , l = 300 times 10^{-3} , m^3 a uma pressão P = 0,3 , atm = 0,3 times 10^5 , Pa é dado por:
W = 0,3 times 10^5 cdot 300 times 10^{-3}
W = 9,0 times 10^3 , J
De acordo com a primeira lei, o calor recebido por um gás é responsável pela variação da energia interna de um gás e o trabalho realizado, ou seja:
Q = Delta U + W
Substituindo-se Delta U e W, temos que:
Q = 9,0 times 10^3 + 7,5 times 10^3
Q = 1,65 times 10^4 , J
Portanto, a resposta correta é a alternativa (A).
