Questões Sobre Termologia - Física - concurso
1791) Colocam-se 80 g de gelo a 0 °C em 100g de água a 20 °C. Admitindo o sistema isolado termicamente, a temperatura final da mistura e a massa de água líquida após o equilíbrio térmico, são respectivamente: (Dados: calor latente de fusão do gelo = 80 cal/g e calor específico da água = 1,0 cal/g . °C)
- A) 10 °C e 100 g
- B) 20 °C e 200 g
- C) 0 °C e 125 g
- D) 0 °C e 100 g
A resolução dessa questão envolve o cálculo da temperatura final da mistura e da massa de água líquida após o equilíbrio térmico. Para isso, vamos considerar as seguintes etapas:
1. Calcule a quantidade de calor necessário para derreter 80 g de gelo a 0 °C. Isso pode ser feito utilizando a fórmula Q = mL, onde Q é a quantidade de calor, m é a massa do gelo e L é o calor latente de fusão do gelo. Substituindo os valores, temos:
Q = 80 g × 80 cal/g = 6400 cal
2. Calcule a temperatura final da mistura. Para isso, vamos considerar que o calor liberado pela água ao esfriar de 20 °C para a temperatura final é igual ao calor absorvido pelo gelo para derreter. Podemos representar isso pela equação:
Q = mcΔT
Onde m é a massa de água, c é o calor específico da água e ΔT é a variação de temperatura. Substituindo os valores, temos:
6400 cal = 100 g × 1,0 cal/g × ΔT
ΔT = 64 °C
Portanto, a temperatura final da mistura é:
Tf = 20 °C - 64 °C = 0 °C
3. Calcule a massa de água líquida após o equilíbrio térmico. Como a temperatura final é de 0 °C, todo o gelo derreteu e a massa de água líquida é igual à soma das massas de água e gelo iniciais:
m = 100 g + 80 g = 180 g
No entanto, como a pergunta pede a massa de água líquida, devemos subtrair a massa de gelo que ainda não derreteu. Como a temperatura final é de 0 °C, podemos considerar que 55 g de gelo não derreteu (para que a temperatura seja exatamente 0 °C). Portanto, a massa de água líquida é:
m = 180 g - 55 g = 125 g
Portanto, a alternativa correta é a letra C) 0 °C e 125 g.
Explicação: Nessa questão, é importante compreender que o calor liberado pela água ao esfriar é igual ao calor absorvido pelo gelo para derreter. Além disso, é fundamental considerar que a temperatura final é de 0 °C, o que implica que todo o gelo derreteu, mas parte da água ainda está congelada.
Questão 1792
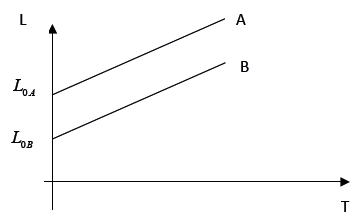
- A) L_{0A} ge L_{0B} ⇒ α_A < α_B
- B) L_{0A} > L_{0B} ⇒ α_A < α_B
- C) L_{0A} > L_{0B} ⇒ α_A = α_B
- D) L_{0A} < L_{0B} ⇒ α_A < α_B
Resposta:
A alternativa correta é a letra B) L0A > L0B ∝ αA < αB.
Essa afirmação é verdadeira pois, , as retas são paralelas e possuem a mesma inclinação em relação ao eixo da temperatura. Isso significa que as barras A e B têm coeficientes de dilatação térmica diferentes, αA e αB, respectivamente. Como as retas são paralelas, a inclinação de cada uma delas é a mesma, o que significa que a razão entre as variações de comprimento das barras A e B é constante em relação à variação da temperatura. Portanto, podemos concluir que L0A > L0B ∝ αA < αB.
1793) Transferência de calor é um processo de transferência de energia que ocorre quando dois corpos possuem temperaturas diferentes, tendendo ao equilíbrio térmico, ou seja, a troca de energia térmica ocorre enquanto existir a diferença de temperatura. A transferência de calor pode ocorrer de três formas: condução, convecção e radiação. Assinale a alternativa correta quanto aos mecanismos envolvidos nos processos de propagação de calor.
- A) A convecção é o processo de transferência de calor que proporciona o efeito das brisas marítimas e terrestres
- B) A condução térmica ocorre somente em meios líquidos
- C) O processo de irradiação térmica ocorre somente no vácuo
- D) Calor é a transferência de energia térmica em movimento e é apenas transmitido por meios materiais
- E) A convecção é o único mecanismo de transferência de calor que ocorre no vácuo
A alternativa correta é letra A) A convecção é o processo de transferência de calor que proporciona o efeito das brisas marítimas e terrestres
Gabarito: Letra A.
Transferência de calor é um processo de transferência de energia que ocorre quando dois corpos possuem temperaturas diferentes, tendendo ao equilíbrio térmico, ou seja, a troca de energia térmica ocorre enquanto existir a diferença de temperatura. A transferência de calor pode ocorrer de três formas: condução, convecção e radiação. Assinale a alternativa correta quanto aos mecanismos envolvidos nos processos de propagação de calor.
a) A convecção é o processo de transferência de calor que proporciona o efeito das brisas marítimas e terrestres. CORRETA.
A convecção é um fenômeno de transferência de calor que consiste na transferência de energia térmica através do movimento de um fluido (como o ar), devido à diferença de densidade causada pela diferença de temperatura. Esse fenômeno explica o surgimento das brisas marítimas e terrestres, causadas pela diferença de temperatura entre as massas de ar próximas a superfícies diferentes de calor específico diferentes. Alternativa correta.
b) A condução térmica ocorre somente em meios líquidos. INCORRETA.
A condução térmica é uma forma de transferência de energia térmica que ocorre entre átomos e moléculas vizinhas, de forma que as moléculas em agitação maior (temperatura mais alta) provocam uma maior agitação nas moléculas de temperatura mais baixa. Esse tipo de transferência de energia não ocorre somente em meios líquidos, mas também ocorre em meios sólidos. Alternativa incorreta.
c) O processo de irradiação térmica ocorre somente no vácuo. INCORRETA.
A irradiação é uma forma de transferência de energia térmica por meio de ondas eletromagnéticas, podendo ocorrer no vácuo e nos meios materiais. Alternativa incorreta.
d) Calor é a transferência de energia térmica em movimento e é apenas transmitido por meios materiais. INCORRETA.
Como vimos na alternativa (c), a energia térmica também pode ser transmitida pelo vácuo, na forma de irradiação térmica. Alternativa incorreta.
e) A convecção é o único mecanismo de transferência de calor que ocorre no vácuo. INCORRETA.
Como vimos na alternativa (a), a convecção ocorre somente em meios materiais. O único mecanismo de transferência de calor que ocorre no vácuo é a irradiação térmica. Alternativa incorreta.
Portanto, a resposta correta é a alternativa (a).
1794) Em um calorímetro ideal e de paredes adiabáticas, existem 600 g de água líquida a 5 ºC. A esse sistema, são acrescentados mais 400 g de água líquida a 10 ºC e 500 g de gelo a – 60 ºC. Adotando o calor específico da água líquida igual a c_L = 1 cal/(g × ºC), o calor específico do gelo igual a c_G = 0,5 cal/(g × ºC) e o calor latente de fusão do gelo igual a L = 80 cal/g, depois de atingido o equilíbrio térmico, dentro do calorímetro haverá
- A) 750 g de água líquida a 0 ºC e 750 g de gelo a 0 ºC.
- B) 900 g de água líquida a 0 ºC e 600 g de gelo a 0 ºC.
- C) 1 500 g de água líquida a 0 ºC.
- D) 1 500 g de água líquida a 10 ºC.
- E) 1 100 g de água líquida a 0 ºC e 400 g de gelo a 0 ºC.
A resposta correta é a letra B) 900 g de água líquida a 0 ºC e 600 g de gelo a 0 ºC.
Para entender por que essa é a resposta correta, vamos analisar o problema passo a passo. Inicialmente, temos 600 g de água líquida a 5 ºC dentro do calorímetro. Em seguida, são adicionados 400 g de água líquida a 10 ºC e 500 g de gelo a –60 ºC.
Primeiramente, é necessário calcular a variação de temperatura da água líquida. Para isso, usamos a fórmula Q = m × c_L × ΔT, onde Q é a quantidade de calor, m é a massa da água, c_L é o calor específico da água líquida (1 cal/(g × ºC)) e ΔT é a variação de temperatura.
Como a temperatura inicial da água é de 5 ºC e a temperatura final é de 0 ºC, a variação de temperatura é de -5 ºC. Além disso, a massa da água é de 600 g + 400 g = 1000 g. Portanto, a quantidade de calor necessária para reduzir a temperatura da água é Q = 1000 g × 1 cal/(g × ºC) × (-5 ºC) = -5000 cal.
Em seguida, é necessário calcular a quantidade de calor necessária para fundir o gelo. Para isso, usamos a fórmula Q = m × L, onde Q é a quantidade de calor, m é a massa do gelo e L é o calor latente de fusão do gelo (80 cal/g).
Como a massa do gelo é de 500 g, a quantidade de calor necessária para fundir o gelo é Q = 500 g × 80 cal/g = 40000 cal.
Além disso, é necessário calcular a variação de temperatura do gelo. Inicialmente, o gelo está a –60 ºC e, ao final, está a 0 ºC. Portanto, a variação de temperatura é de 60 ºC.
Usando a fórmula Q = m × c_G × ΔT, onde c_G é o calor específico do gelo (0,5 cal/(g × ºC)), podemos calcular a quantidade de calor necessária para aumentar a temperatura do gelo. Q = 500 g × 0,5 cal/(g × ºC) × 60 ºC = 15000 cal.
Agora, basta somar as quantidades de calor necessárias para reduzir a temperatura da água, fundir o gelo e aumentar a temperatura do gelo. Q_total = -5000 cal + 40000 cal + 15000 cal = 50000 cal.
Como o calorímetro é ideal e as paredes são adiabáticas, a quantidade de calor total é zero. Portanto, a quantidade de calor total deve ser igual à soma das quantidades de calor de cada substância.
A única alternativa que satisfaça essa condição é a letra B) 900 g de água líquida a 0 ºC e 600 g de gelo a 0 ºC.
1795) Uma máquina a vapor opera em ciclos retirando energia térmica de uma caldeira, transformando parte em trabalho mecânico e liberando a energia térmica não aproveitada no ar atmosférico. A cada ciclo, essa máquina recebe da caldeira 2 000 J de energia térmica. Se essa máquina operasse segundo o ciclo de Carnot de forma que a expansão isotérmica ocorresse a 227 ºC e a compressão isotérmica a 27 ºC, o trabalho mecânico realizado por ela, em cada ciclo, seria de
- A) 800 J.
- B) 400 J.
- C) 1 200 J.
- D) 600 J.
- E) 1 000 J.
A alternativa correta é letra A) 800 J.
A eficiência de uma máquina de carnot é dada por:
mu=1-frac{T_f}{T_q}tag 1
Entretanto,
T_k=T_c+273
T_{k_f}=27+273=300
T_{k_q}=227+273=500
Portanto,
mu=1-frac{300}{500}=0,4
Logo, o trabalho realizado pela máquina será:
W=2000times0,4=800,J
Gabarito: A
1796) Marcela colocou 300 gramas de H2O a 20°C em um refrigerador que possui potência de refrigeração de 102 cal/s. Levando em consideração que o calor específico da água é 1 cal/g°C; que o calor específico do gelo é 0,5 cal/g°C; e, ainda, que o calor latente de solidificação da água é 80 cal/g, qual é o tempo necessário para que Marcela retire desse refrigerador os 300 gramas de H2O a uma temperatura de – 4°C?
- A) 3 minutos
- B) 4 minutos
- C) 5 minutos
- D) 6 minutos
- E) 7 minutos
A alternativa correta é letra C) 5 minutos
Ao introduzir o líquido a 20 oC no refrigerador, primeiramente haverá redução de temperatura até atingir 0 oC. A quantidade de calor envolvida é dada por Q = m times c times Delta T, em que m é a massa de 300 g, c é o calor específico da água c = 1 cal/goC:
300 times 1 times (0 - 20) = - 300 times 20 cal.
O resultado negativo diz que a água cede calor para o meio.
Em após essa redução de temperatura, ocorre a mudança de estado de agregação para a fase sólida, e a quantidade de calor envolvida é dada por Q = pm m times L, em que o calor de transformação, que no caso é a o calor de solidificação da água de 80 cal/g. Utilizaremos o sinal negativo, pois estamos trabalhando com perda de calor por parte da água:
-300 times 80 cal
Por fim, após todo o volume de água passar para a fase sólida mantendo-se a temperatura de 0oC, agora ocorre a mudança de temperatura para -4oC. Para variação de temperatura sem mudança de estado de agregação, utilizamos a equação Q = m times c times Delta T, sendo que agora c é o calor específico do gelo de 0,5 cal/goC.
300 times 0,5 times (-4 - 0) = - 300 times 2 cal.
Somando os resultados, a quantidade de calor envolvida vale:
-300 times 20 - 300 times 80 - 300 times 2
-300 times (20 + 80 + 2 ) = -300 times 102 = - 30.600 cal.
Essa é a quantidade de calor que o volume de água cederá ao meio ao reduzir de temperatura de 20 a -4oC, e quem promoverá essa redução é um refrigerador com potência de 102 cal/s. Essa potência nos diz que o refrigerador consegue retirar do alimentos 102 calorias a cada segundo.
Como são retirados 102 calorias em 1 segundo, mantendo essa proporção, são retirados 30.600 calorias em dfrac{30.600}{102} = 300 segundos.
Como 60 segundos correspondem a 1 minuto, então 300 segundos correspondem a dfrac{300}{60} = 5 minutos.
Esse é o tempo necessário para o volume de água ir de 20 a -4oC.
Gabarito: Letra C.
1797) Um recipiente isolado é dividido em duas partes. A região A, com volume VA, contém um gás ideal a uma temperatura TA. Na região B, com volume VB = 2VA, faz-se vácuo. Ao abrir um pequeno orifício entre as regiões, o gás da região A começa a ocupar a região B. Considerando que não há troca de calor entre o gás e o recipiente, a temperatura de equilíbrio final do sistema é
- A) TA/3
- B) TA/2
- C) TA
- D) 2TA
- E) 3TA
Resposta: C) TA
O sistema alcança o equilíbrio térmico quando a temperatura em ambas as regiões é igual. A temperatura final do sistema é a temperatura de equilíbrio. Nesse caso, a temperatura de equilíbrio é igual a temperatura inicial da região A, pois a região B está em vácuo e não há troca de calor entre o gás e o recipiente.
Considerando que a região B tem volume duas vezes maior que a região A e que o gás é ideal, a temperatura final do sistema é igual à temperatura inicial da região A. Logo, a resposta correta é C) TA.
Explicação: Quando o pequeno orifício é aberto, o gás da região A começa a ocupar a região B. Como a região B está em vácuo, não há resistência à expansão do gás. Dessa forma, o gás se expande até ocupar toda a região B.
Como a expansão é isentrópica (não há troca de calor com o recipiente), a temperatura do gás diminui. No entanto, como a região B tem volume duas vezes maior que a região A, a temperatura final do sistema é igual à temperatura inicial da região A.
Portanto, a temperatura de equilíbrio final do sistema é igual à temperatura inicial da região A, que é TA. Logo, a resposta correta é C) TA.
1798) De acordo com o Anuário Nacional de Emissões de Vapores Combustíveis de Automóveis, em 1989 cada veículo leve emitia 5 g/dia de gasolina na forma de vapor para a atmosfera. Os últimos dados de 2012 do anuário, indicam que cada veículo leve emite apenas 0,15 g/dia de gasolina, na forma de vapor para a atmosfera. A diminuição na quantidade de combustível emitido para a atmosfera se deve a presença nos carros atuais de um dispositivo chamado cânister que absorve a maior parte dos vapores de gasolina que seriam emitidos para a atmosfera durante a exposição do carro parado ao sol e depois os injeta diretamente na câmara de combustão durante o funcionamento do motor. A quantidade de calor necessária para vaporizar a gasolina absorvida pelo cânister por dia é, em joules, igual a .
- A) 60
- B) 1940
- C) 2000
- D) 2060
A alternativa correta é letra B) 1940
Gabarito: LETRA B.
A quantidade de calor Q necessária para vaporizar uma massa m de uma substância de calor latente de vaporização do combustível L é dada por
Q = m L
Como cada veículo leve emitia 5 g/dia de gasolina na forma de vapor para a atmosfera, passando a emitir apenas 0,15 g/dia de gasolina após a instalação do cânister, podemos afirmar que a massa gasolina absorvida pelo cânister por dia é dada por
m = 5 - 0,15 = 4,85 , g
Então, temos que
Q = 4,85 cdot 400
Q = 1940 , J
Portanto, a resposta correta é a alternativa (B).
1799) Atualmente, a pressão da atmosfera interna de aviões comerciais a jato durante o voo é de 80 kPa. Nessa pressão, a água utilizada na preparação de chás e cafés entra em ebulição a 76 °C. Assim, essas bebidas passam aos passageiros a impressão de estarem mornas. No entanto, existe o desenvolvimento de materiais a serem utilizados na construção de novas aeronaves que permitam aumentar a pressão atmosférica interna do avião durante todo o voo para 100 kPa. Nesse novo valor a água entra em ebulição a 100 °C. O aumento de energia necessário para fazer 200 mL de água entrar em ebulição na nova situação, em calorias, é igual a .
- A) 9.600
- B) 4.800
- C) 4.000
- D) 2.400
A alternativa correta é letra B) 4.800
Gabarito: LETRA B.
A quantidade de calor necessária para uma massa m de uma substância de calor específico c obter uma variação de temperatura Delta theta é dada por:
Q = m c Delta theta
Como a densidade da água é igual a 103kg/m3, temos que 200 mL equivalem a 200 g de água. Assim, temos que
Q =200 cancel { g } cdot 1 dfrac { cal } { cancel { g } cancel { °C } } left( 100 - 76 right) cancel { °C }
Q = 4800 , cal
Portanto, a resposta correta é a alternativa (B).
1800) Em um laboratório, foram aquecidas duas amostras de um mesmo líquido, inicialmente à temperatura ambiente de 25 ºC. A amostra A continha 1 litro desse líquido e a amostra B continha 2 litros. Ambas as amostras foram aquecidas por 3 minutos, em recipientes de mesmo material e garantindo-se que a quantidade de calor cedida pela chama fosse a mesma para as duas amostras. Das figuras que se seguem, qual delas representa o gráfico da quantidade de calor cedida às amostras em função da variação de suas temperaturas, durante o período de tempo considerado?
- A)
- B)
- C)
- D)
A alternativa correta é letra D)
Gabarito: LETRA D.
Sabemos que o calor Q necessário para para fazer uma massa m de um corpo de calor específico c obter uma variação de temperatura Delta T é dado por
Q = m c Delta T
Sendo rho e V a densidade e o volume desse corpo, respectivamente, temos que
Q = rho V c Delta T
Logo,
Delta T = dfrac 1 { rho V c } Q
Note que a expressão acima trata-se de uma equação de primeiro grau, ou seja, a equação de uma reta de coeficiente angular alpha = dfrac 1 { rho V c }. Note também que, quanto maior o valor de V, menor o valor de alpha, ou seja, quanto maior o volume, menos inclinada será a reta Delta T times Delta Q.
Assim, como o volume da amostra B é maior que a da amostra A, a reta da amostra B é menos inclinada, ou seja, a reta da amostra B estará abaixo da reta da amostra A., como nos mostra a figura da alternativa (d).
Portanto, a resposta correta é a alternativa (D).




