Questões Sobre Termologia - Física - concurso
1831) A tabela a seguir informa o calor específico de algumas substâncias.
- A) I, apenas.
- B) II, apenas.
- C) I e III, apenas.
- D) II e III, apenas.
- E) I, II e III.
A alternativa correta é letra C) I e III, apenas.
Gabarito: LETRA C.
I. A água, por ter um calor específico muito alto, é um excelente elemento termorregulador. A ausência de água faz com que, nos desertos, ocorram enormes diferenças entre a temperatura máxima e a mínima em um mesmo dia.
CORRETA.
A grande diferença entre a temperatura máxima e a mínima em um mesmo dia, chamada de amplitude térmica, é comum em ambientes desérticos pois o solo dessas áreas são arenosos e, portanto, apresentam baixo calor específico. Dessa forma, essas áreas tendem a aquecer muito rápido, devido à pouca quantidade de calor necessária para elevar sua temperatura, bem como esfriam rapidamente pelo mesmo fator. Esse tipo de clima é causado pela escassez de água, que funciona como um termorregulador, já a água necessita de uma grande quantidade de calor para variar sua temperatura em 1ºC. Afirmativa correta.
II. Para refrigerar uma peça aquecida, é comum mergulhá-la em água. Será mais eficiente, para resfriá-la, mergulhá-la em mercúrio. Só não se faz isso porque, além de muito caro, seus vapores são extremamente tóxicos.
INCORRETA.
Note que o mercúrio apresenta o menor calor específico da tabela. Logo, não será eficiente resfriar a peça aquecida utilizando-o, pois esse elemento necessita de pouco calor para elevar sua temperatura em 1ºC. Para ser mais eficiente, essa peça deve ser resfriada mergulhando-a em água. Afirmativa incorreta.
III. Se cedermos a mesma quantidade de calor a amostras de massas iguais de alumínio e ferro, a temperatura da amostra de ferro aumentará o dobro do que aumenta a amostra de alumínio.
CORRETA.
Sabemos que a quantidade de calor Q necessária para fazer uma massa m de uma substância de calor específico c variar sua temperatura em Delta theta é dada por
Q = mc Delta theta
Assim, se cedermos a mesma quantidade de calor a amostras de massas iguais de alumínio e ferro, podemos escrever:
Q_{Fe} = Q_{Al}
m_{Fe} cdot c_{Fe} cdot Delta theta_{Fe} = m_{Al} cdot c_{Al} cdot Delta theta_{Al}
Como m_{Fe} = m_{Al} , temos que
cancel { m_{Al} } cdot c_{Fe} cdot Delta theta_{Fe} = cancel { m_{Al} } cdot c_{Al} cdot Delta theta_{Al}
Delta theta_{Fe} = dfrac { c_{Al} } { c_{Fe} } cdot Delta theta_{Al}
Substituindo-se os valores da tabela, temos que
Delta theta_{Fe} = dfrac { 0,22 } { 0,11 } cdot Delta theta_{Al}
Delta theta_{Fe} = 2 Delta theta_{Al}
Ou seja, a temperatura da amostra de ferro aumentará o dobro do que aumenta a amostra de alumínio. Afirmativa correta.
Portanto, a resposta correta é a alternativa (c).
1832) A maioria da população possui a concepção de calor como sendo uma substância, o que leva a concepções que se distanciam do conteúdo científico sobre o tema. Considerando este contexto analise as asserções a seguir e a relação entre elas.
- A) A asserção I é uma proposição falsa, e a II é uma proposição verdadeira.
- B) As asserções I e II são proposições verdadeiras, e a II é uma justificativa correta da I.
- C) As asserções I e II são proposições verdadeiras, mas a II não é uma justificativa correta da I.
- D) A asserção I é uma proposição verdadeira, e a II é uma proposição falsa.
- E) As asserções I e II são proposições falsas.
A alternativa correta é letra A) A asserção I é uma proposição falsa, e a II é uma proposição verdadeira.
Gabarito: LETRA A.
I - É correto afirmar que um bom cobertor impede que o frio passe através dele.
FALSA. A sensação de frio ocorre pelo fato de o corpo humano liberar calor. Espontaneamente, o calor tende a fluir do corpo mais quente para o mais frio. Assim, em baixas temperaturas, sentimos frio quando perdemos calor para o ambiente. Dessa forma, o que o coberto impede é a passagem de calor através dele.
Logo, a proposição é falsa.
II - O cobertor age como um isolante térmico, evitando que haja a troca de calor entre a pessoa e o meio.
VERDADEIRA. De fato, o cobertor age como um isolante térmico, diminuindo a taxa de transferência de calor do corpo humano para o meio externo. Isso ocorre devido à baixa condutividade térmica do material de que é feito, impedindo que o corpo humano libere muito calor ao ambiente.
Logo, a proposição é verdadeira.
Portanto, a resposta correta é a alternativa (a).
1833) Uma porta retangular de vidro, de 12 mm de espessura, 2,0 m de altura e 1,0 m de largura, separa um ambiente, onde a temperatura é mantida a 20 ºC, do meio externo, cuja temperatura é – 4 ºC.
- A) 1200
- B) 2400
- C) 3200
- D) 4800
A alternativa correta é letra C) 3200
Gabarito: LETRA C.
Para que a temperatura desse ambiente se mantenha constante, a potência do aquecedor deve ser igual ao fluxo de calor que atravessa a porta para o meio externo. De acordo com a lei da condução térmica, também conhecida como lei de Fourier, esse fluxo de calor é dado por:
Phi = dfrac { K cdot A cdot Delta T } { L }
Onde K é a condutividade térmica do material, A a área, L a espessura e Delta T é a diferença de temperatura entre os ambientes. Dos dados da prova, temos que a condutividade térmica do vidro é K = 0,8 W/ left( m cdot K right). Assim, substituindo os valores do enunciado, temos que:
Phi = dfrac { 0,8 cdot 2,0cdot 1,0 cdot left( 20 - left( -4 right) right) } { 0,012 }
Phi = 3200 , W
Portanto, a resposta correta é a alternativa (c).
Questão 1834
1ª etapa: no interior de um recipiente adiabático, de capacidade térmica desprezível, colocou-se certa quantidade de água que foi aquecida por uma resistência elétrica R. Utilizando-se de um amperímetro A e de um voltímetro V, ambos ideais, manteve-se a corrente e a voltagem fornecidas por uma bateria em 2 A e 20 V, conforme ilustrado na Figura 1.
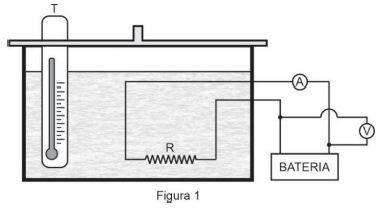
Com a temperatura θ lida no termômetro T, obteve-se, em função do tempo de aquecimento Δ t, o gráfico representado na Figura 2.
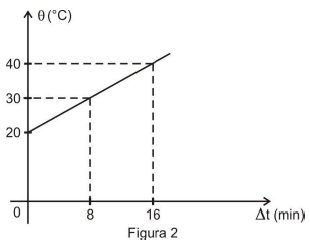
2ª etapa: repete-se a experiência, desde o início, desta vez, colocando o objeto de material desconhecido imerso na água. Sem alterar a quantidade de água, a corrente e a tensão no circuito elétrico, obteve-se o gráfico representado na Figura 3.
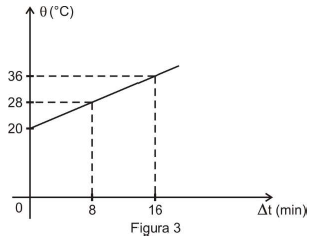
Considerando que, em ambas as etapas, toda energia elétrica foi dissipada por efeito Joule no resistor R, pode-se concluir que o calor específico do material de que é feito o objeto é, em cal/(g∙°C) igual a
- A) 0,15
- B) 0,20
- C) 0,35
- D) 0,80
A alternativa correta é letra B) 0,20
Gabarito: LETRA B.
Sabemos que a potência dissipada no resistor é dada por:
P = iU
Porém, sabemos que a potência será utilizada para aquecer o interior do recipiente. Assim, podemos escrever:
P = dfrac { E } { Delta t }
P = dfrac { Q } { Delta t }
Logo,
P = iU = dfrac { mcDelta theta } { Delta t } tag 1
Para a 1ª etapa, temos que:
P = dfrac { m_{água} c_{água} Delta theta_1 } { Delta t } tag 2
Para a 2ª etapa, temos que:
P = dfrac { m_{água} c_{água} Delta theta_2 + m_{objeto} c_{objeto} Delta theta_2 } { Delta t } tag 3
Das equações (2) e (3), temos que:
dfrac { m_{água} c_{água} Delta theta_1 } { cancel{ Delta t } } = dfrac { m_{água} c_{água} Delta theta_2 + m_{objeto} c_{objeto} Delta theta_2 } { cancel{ Delta t } }
m_{água} c_{água} left( Delta theta_1 - Delta theta_2 right) = m_{objeto} c_{objeto} Delta theta_2
c_{objeto}= dfrac { m_{água} c_{água} left( Delta theta_1 - Delta theta_2 right) } { m_{objeto} Delta theta_2 } tag 4
Da equação (1), para a 1ª etapa, podemos escrever:
iU = dfrac { m_{água} c_{água} Delta theta_1 } { Delta t }
Logo,
m_{água} c_{água}= dfrac { iU Delta t } { Delta theta_1 } tag 5
Substituindo (5) em (4), temos que:
c_{objeto}= dfrac { dfrac { iU Delta t } { Delta theta_1 } left( Delta theta_1 - Delta theta_2 right) } { m_{objeto} Delta theta_2 }
c_{objeto}= dfrac { iU Delta t left( Delta theta_1 - Delta theta_2 right) } { m_{objeto} Delta theta_1 Delta theta_2 }
Substituindo os valores, temos que:
c_{objeto}= dfrac { 2 cdot 20 cdot 16 cdot 60 left( 20 - 16 right) } { 0,600 cdot 20 cdot 16 }
c_{objeto}= 800 , J/kg°C
Como 1 , cal approx 4 , J (utilizando as informações da prova), temos que:
c_{objeto}= 200 , cal/kg°C
c_{objeto}= 0,2 , cal/g°C
Portanto, a resposta correta é a alternativa (b).
1835) Devido à pandemia de covid-19, a Olimpíada, que deveria ocorrer no ano de 2020 no Japão, foi adiada para o ano de 2021. Uma das provas olímpicas é a de tiro ao alvo, praticado com carabina de ar.
- A) 484ºC.
- B) 93,0ºC.
- C) 115ºC.
- D) 10,7ºC.
- E) 21,4ºC.
Resposta: C) 115°C.
Para encontrar a elevação da temperatura do projétil, precisamos calcular a energia cinética do projétil no momento em que toca a parede e, posteriormente, converter essa energia em energia térmica.
A energia cinética do projétil pode ser calculada pela fórmula:
$$E_c = frac{1}{2} cdot m cdot v^2$$Substituindo os valores dados no problema, temos:
$$E_c = frac{1}{2} cdot 0,149 kg cdot (300 m/s)^2 = 675 J$$Como a energia cinética foi completamente convertida em energia térmica, podemos igualar essa energia à variação de energia térmica do projétil:
$$E_c = Q = m cdot c cdot Delta T$$Substituindo os valores dados no problema, temos:
$$675 J = 0,149 kg cdot 0,093 cal/g°C cdot Delta T$$Resolvendo para ΔT, encontramos:
$$Delta T = frac{675 J}{0,149 kg cdot 0,093 cal/g°C} = 115°C$$Portanto, a alternativa correta é C) 115°C.
1836) Texto associado
- A) 108 cm.
- B) 12,0 cm.
- C) 36,0 mm.
- D) 108 mm.
- E) 75 mm.
A resposta para essa questão de Física sobre Termologia é a letra D) 108 mm.
Para chegar a essa resposta, precisamos calcular a variação total no comprimento da seção devido à variação térmica entre as temperaturas de 12°C e 42°C. Para isso, vamos utilizar a fórmula de dilatação térmica linear:
ΔL = α * L * ΔT
Onde ΔL é a variação no comprimento, α é o coeficiente de dilatação térmica linear do aço (1,2 x 10^(-5) K^(-1)), L é o comprimento inicial da seção (300 m) e ΔT é a variação de temperatura (30°C = 30 K).
Substituindo os valores, temos:
ΔL = 1,2 x 10^(-5) K^(-1) * 300 m * 30 K
ΔL ≈ 0,108 m
Convertendo para mm, temos:
ΔL ≈ 108 mm
Portanto, a variação total no comprimento da seção devido à variação térmica entre as temperaturas de 12°C e 42°C é de aproximadamente 108 mm.
1837) Considere dois corpos de matérias, A e B, ambos de mesma massa. Se o material que constitui o corpo A tem calor específico três vezes maior que o do corpo B e cedermos aos dois corpos a mesma quantidade de calor, é correto afirmar que a variação de temperatura
- A) do corpo B será três vezes maior que a do corpo A.
- B) nos dois corpos será a mesma.
- C) dos dois corpos só poderá ser considerada se ambos forem sólidos.
- D) do corpo À será um terço da variação de temperatura do corpo B.
- E) do corpo À será três vezes maior que a do corpo B.
Since this question was annulled and does not have a correct answer, I will explain the concept behind it.
The correct answer would be related to the concept of specific heat capacity. Specific heat capacity is the amount of heat energy required to raise the temperature of a unit mass of a substance by one degree Celsius. In this case, we have two bodies A and B, both with the same mass, and we are told that the specific heat capacity of body A is three times greater than that of body B.
When the same amount of heat is added to both bodies, the temperature change will be different. Since the specific heat capacity of body A is greater, it will absorb more heat energy to raise its temperature by one degree Celsius compared to body B. This means that the temperature change of body A will be smaller than that of body B.
Therefore, if we were to choose an answer, it would be option E) the temperature change of body A will be one-third of the temperature change of body B. However, since the question was annulled, we cannot consider any of the options as correct.
In conclusion, the key to this question is understanding the concept of specific heat capacity and how it affects the temperature change of a substance when heat energy is added or removed.
1838) Em um processo há a necessidade de se transformar gelo, que se encontra a -25ºC, em vapor a 250ºC. Em relação a esse processo, assinale a afirmativa INCORRETA.
- A) É necessário fornecer 83,68kJ para elevar a temperatura da água de 0ºC até 100ºC.
- B) A vaporização da água requer o fornecimento de 108kcal.
- C) Para elevar o vapor a 250ºC, é necessário o fornecimento de 15,0kcal.
- D) O processo de fusão do gelo ocorre entre -25ºC e 0ºC e necessita que sejam fornecidos 16 kcal.
- E) Durante a vaporização, o sistema recebe energia, mas não há elevação de temperatura.
Afirmativa INCORRETA: D) O processo de fusão do gelo ocorre entre -25°C e 0°C e necessita que sejam fornecidos 16 kcal.
Explicação:
O processo de transformação do gelo a -25°C em vapor a 250°C envolve dois processos principais: a fusão do gelo e a vaporização da água. Para calcular a energia necessária para essa transformação, precisamos considerar as energias envolvidas em cada processo.
Primeiramente, para fundir 1 g de gelo a -25°C, é necessário fornecer uma energia de 80 cal (calor latente de fusão do gelo). Além disso, para elevar a temperatura do gelo fundido de 0°C a 100°C, é necessário fornecer uma energia de 1 cal/g°C × 100°C = 100 cal (calor específico da água).
Em seguida, para vaporizar 1 g de água a 100°C, é necessário fornecer uma energia de 540 cal (calor latente de vaporização da água). Além disso, para elevar a temperatura do vapor de 100°C a 250°C, é necessário fornecer uma energia de 0,5 cal/g°C × 150°C = 75 cal (calor específico do vapor).
Portanto, a energia total necessária para transformar 1 g de gelo a -25°C em vapor a 250°C é de 80 cal (fusão) + 100 cal (aquecimento da água) + 540 cal (vaporização) + 75 cal (aquecimento do vapor) = 795 cal.
Como a afirmação D) indica que o processo de fusão do gelo ocorre entre -25°C e 0°C e necessita que sejam fornecidos 16 kcal, essa afirmação é INCORRETA.
Observação: Note que a unidade de medida utilizada para a energia é cal (calorias) e não kcal (quilocalorias). Além disso, é importante lembrar que a conversão entre cal e kcal é de 1 kcal = 1000 cal.
1839) Três esferas, x, y e z, feitas com materiais diferentes e de massas iguais estavam, inicialmente, à mesma temperatura ambiente (θamb) e foram mergulhadas, simultaneamente, em água pura em ebulição, até entrarem em equilíbrio térmico com a água. Em seguida, foram retiradas da água e deixadas sobre uma superfície isolante, até voltarem à mesma temperatura ambiente. Os calores específicos dos materiais das esferas são cx, cy e cz, de modo que cx < cy < cz. Com os resultados desse experimento, foram construídos o gráfico 1, relativo ao aquecimento das esferas até a temperatura de ebulição da água, e o gráfico 2, relativo ao resfriamento das esferas, até retornarem à temperatura ambiente.
- A)
- B)
- C)
- D)
- E)
A alternativa correta é letra A)
A solução deste exercício será realizada de duas maneiras diferentes, sendo que o Método 2 apresenta mais conceitos matemáticos.
Método 1
Podemos associar o calor específico sensível (c) à "resistência" que o material possui para alterar 1°C em sua temperatura.
Um material com calor específico grande necessita de mais calor para aumentar sua temperatura quando comparado com um material de menor calor específico. Sendo a taxa de transferência de calor constante, podemos concluir que quanto maior o calor específico, maior o tempo necessário para atingir determinada temperatura.
Como:
c_x lt c_y lt c_z
Sendo os tempos para as esferas x, y e z atingirem a temperatura de ebulição respectivamente (Delta t_x, Delta t_y, Delta t_z), então:
Delta t_x lt Delta t_y lt Delta t_z
De acordo com o exposto, o gráfico 1 deverá ficar como o da figura abaixo.
Este gráfico está representado corretamente no gráfico 1 das alternativas A e E.
O raciocínio é o mesmo para o resfriamento das esferas, portanto a esfera com menor calor específico resfriará primeiro que a de maior calor específico. Portanto o gráfico 2 ficará da seguinte forma:
Analisando as alternativas, vemos que a alternativa que representa corretamente os gráficos 1 e 2 é a alternativa A.
Método 2:
Como o gráfico em questão representa variação de temperatura em função do tempo (Delta theta;vs;Delta t), devemos encontrar uma equação que relacione essas grandezas e analisar o coeficiente angular dessa equação.
Sabemos que:
Q=mcdot c cdot Delta theta
Como a transferência de calor é feita a uma taxa constante, isso quer dizer:
Q= K cdot Delta t
onde K é a taxa de transferência de calor. Invertendo a primeira equação e substituindo, temos:
mcdot c cdot Delta theta=Q
mcdot c cdot Delta theta= K cdot Delta t
Isolando Delta theta:
Delta theta= color{brown}{dfrac{K }{ mcdot c}}cdot Delta t
O termo que acompanha Delta t , a=color{brown}{dfrac{K}{m cdot c}} é o coeficiente angular da reta, ele mostra a inclinação da reta no gráfico de temperatura em função do tempo. Como K e m são os mesmos para as três esferas, temos que a inclinação será inversamente proporcional ao calor específico do material, então quanto maior o calor específico, menor a inclinação da reta.
Como
c_x lt c_y lt c_z
Então as inclinações das retas x, y e z respectivamente serão decrescentes:
a_x gt a_y gt a_z
A alternativa que representa corretamente os gráficos 1 e 2 , com as inclinações decrescente das retas x, y e z respectivamente, são os gráficos da alternativa A.
Questão 1840
Texto 1A3-III
Muitos dos incêndios modernos ocorrem em ambientes fechados, condição que impõe uma dinâmica característica ao fogo e à sua propagação. No espaço confinado, observa-se o fenômeno do flashover, no qual ocorre uma ignição instantânea de materiais combustíveis voláteis que foram levados ao estado de combustão iminente pela temperatura ambiente, que gradativamente se eleva. O gráfico seguinte mostra a evolução da temperatura em relação ao tempo durante o início de um incêndio.
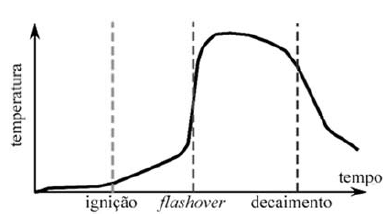
Internet: <www.researchgate.net> (com adaptações).
A partir das informações do texto 1A3-III, é correto afirmar que a energia térmica produzida em um incêndio em um ambiente fechado é transmitida para o ambiente circundante por meio de
- A) convecção, refração e condução.
- B) condução, irradiação e fricção.
- C) condução, irradiação e convecção.
- D) convecção, reflexão e refração.
A alternativa correta é letra C) condução, irradiação e convecção.
A energia térmica produzida em um incêndio em um ambiente fechado é transmitida para o ambiente circundante por meio de das correntes de convecção, por irradiação e por conduções nos meio sólidos existentes no ambiente.
A elevação da temperatura alcança patamares tão altos que alguns materiais atingem seu ponto de ignição sem a necessidade de contato com as chamas.
O Flashover ocorre porque a camada de gases aquecidos do incêndio, acumulados no teto da edificação, irradia calor para os materiais combustíveis que estão longe da origem do fogo.
Os gases produzidos durante a fase de crescimento do fogo se aquecem até a temperatura de ignição, ficando toda a área envolvida por chamas.





