Questões Sobre Termologia - Física - concurso
1871) Um bom café deve ser preparado a uma temperatura pouco acima de 80ºC. Para evitar queimaduras na boca, deve ser consumido a uma temperatura mais baixa. Uma xícara contém 60 mL de café a uma temperatura de 80ºC. Qual a quantidade de leite gelado (a uma temperatura de 5ºC) deve ser misturada ao café para que a temperatura final do café com leite seja de 65ºC?
- A) 5 mL
- B) 10 mL
- C) 15 mL
- D) 20 mL
- E) 25 mL
Note e adote:
Considere que o calor específico e a densidade do café e do leite sejam idênticos.
A alternativa correta é letra C) 15 mL
Gabarito: LETRA C.
Ignorando-se trocas de calor com o ambiente, podemos afirmar que a quantidade de calor cedida pelo resfriamento do café é igual à quantidade de calor absorvido no aquecimento do leite, ou seja:
Q_{leite} = Q_{café}
Assim, podemos escrever:
m_{leite} cdot c_{leite} cdot Delta T_{leite} = m_{café} cdot c_{café} cdot Delta T_{café}
Lembrando que a massa m pode ser escrita em função da densidade rho e do volume V através da equação m = rho cdot V, temos que:
rho_{leite} cdot V_{leite} cdot c_{leite} cdot Delta T_{leite} = rho_{café} cdot V_{café} cdot c_{café} cdot Delta T_{café}
Logo,
V_{leite} = dfrac { rho_{café} cdot V_{café} cdot c_{café} cdot Delta T_{café} } { rho_{leite} cdot c_{leite} cdot Delta T_{leite} }
Considerando que o café e o leite, por serem constituídos basicamente de água, possuem aproximadamente a mesma densidade e o mesmo calor específico, a equação acima se torna:
V_{leite} = dfrac { cancel { rho_{café} } cdot V_{café} cdot cancel { c_{café} } cdot Delta T_{café} } { cancel { rho_{leite} } cdot cancel { c_{leite} } cdot Delta T_{leite} }
V_{leite} = dfrac { V_{café} cdot Delta T_{café} } { Delta T_{leite} }
Substituindo os valores do enunciado, temos que:
V_{leite} = dfrac { 60 cdot left( 80 - 65 right) } { left( 65 - 5 right) }
V_{leite} = 15 , mL
Portanto, a resposta correta é a alternativa (c).
Questão 1872
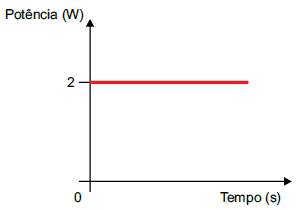
Sabendo que o calor específico da platina é 0,03 cal/(g · ºC) e adotando 1 cal = 4J, o alarme sonoro disparará, pela primeira vez, no instante
- A) t = 8 min.
- B) t = 6 min.
- C) t = 10 min.
- D) t = 3 min.
- E) t = 12 min.
A alternativa correta é letra E) t = 12 min.
Recordando a definição de de potência térmica, podemos utilizar a relação para encontrar o tempo necessário para a peça absorver a energia térmica suficiente para atingir a temperatura que irá disparar o alarme sonoro. Isolando o tempo (Delta t), temos:
Pot = dfrac{Q}{Delta t};;; implies ;;; bbox[8px, border: 1px solid black]{color{black}{Delta t =dfrac{Q}{Pot}}} tag {1}
A energia térmica (Q) que a peça de platina deve receber para aumentar sua temperatura de 20 ^circ C para 80 ^circ C pode ser calculada pela relação:
Q=m cdot c_{pt} cdot Delta theta
Onde
- m: massa da peça de platina = 200,g;
- c_{pt}: calor específico da platina = 0,03,cal/g^circ C;
- Delta theta: variação de temperatura sofrida pela peça = Delta theta = 80-20 = 60 ^circ C.
Substituindo os dados, temos:
Q=m cdot c_{pt} cdot Delta theta
Q=200 cdot 0,03 cdot 60
Q=360,cal
Como a potencia foi dada em W = J/s , devemos converter a energia obtida para joules. Para isso podemos utilizar a relação:
begin{array}{ll} 1,color{brown}{cal} = 4,J ;;; implies ;;; & Q = 360,color{brown}{cal} = 360cdot color{brown}{4J} \ , \ , & Q=1,440,J end{array}
Retornando à equação (1) temos:
Delta t =dfrac{Q}{Pot}
Delta t =dfrac{1440}{2}
bbox[8px, border: 1px solid black]{color{black}{Delta t =720,s}}
Convertendo para minutos, temos:
Delta t= 720 div 60;;; implies ;;; bbox[8px, border: 2px solid #3498db]{color{#3498db}{Delta t = 12,min}}
Logo o alarme sonoro disparará, pela primeira vez, no instante color{#3498db}{t=12,min}.
Questão 1873
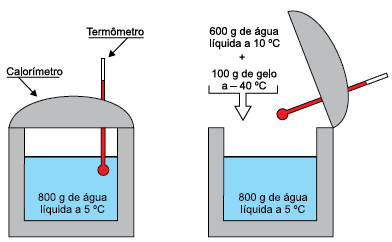
Sabendo que o calor específico da água líquida é 1 cal/(g · ºC), que o calor específico do gelo é 0,5 cal/(g · ºC) e que o calor latente de fusão do gelo é 80 cal/g, depois de atingido o novo equilíbrio térmico havia, dentro do calorímetro,
- A) 1 500 g de água líquida a 10 ºC.
- B) 1 450 g de água líquida e 50 g de gelo a 0 ºC.
- C) 1 500 g de gelo a – 5 ºC.
- D) 1 500 g de água líquida a 0 ºC.
- E) 1 500 g de gelo a 0 ºC.
A alternativa correta é letra D) 1 500 g de água líquida a 0 ºC.
Tanto a água que está à 5^circ C (porção de água 1) quanto a água à 10^circ C (porção de água 2) irão fornecer calor para a o gelo. O gelo irá aquecer até 0 ^circ C e caso haja diferença de temperatura entre as porções de água e de gelo a transferência de energia irá continuar.
Vamos incialmente calcular a quantidade de calor que o gelo deve absorver para aquecer até 0^circ C.
Q_1 = (m cdot c cdot Delta theta)_{mbox{gelo}}
Q_1 = 100 cdot 0,5 cdot [0-(-40)]
Q_1 = 50 cdot 40
Q_1 = 2,000mbox{ cal}
Calculando agora a quantidade de calor que as porções de água podem disponibilizar ao se resfriarem até 0^circ C.
Q_2 = (m cdot c cdot Delta theta)_{mbox{água 1}}+(m cdot c cdot Delta theta)_{mbox{água 2}}
Q_2 = 800 cdot 1cdot (0-5)+600 cdot 1 cdot (0-10)
Q_2 = -4,000 - 6,000
Q_2 = -10,000 mbox{ cal}
Analisando os resultados obtidos vemos que o gelo necessita de 2000 calorias para aquecer até 0 ^circ. As duas porções de água ao resfriarem perdem 10000 calorias (por isso o sinal negativo) e parte deste calor foi absorvido pelo gelo (2000 calorias) e parte ainda está disponível no sistema (8000 calorias).
Dando continuidade ao processo, temos agora 100 g de gelo à 0^circ C, 1400 g de água à 0^circ C e 8000 calorias disponíveis dentro do sistema. Com esse calor disponível a próxima etapa é a fusão do gelo. Calculando a energia necessária para a fusão do gelo:
Q_3 = mcdot L_f
Q_3 = 100 cdot 80
Q_3 = 8,000mbox{ cal}
Podemos ver que a quantidade de calor necessário para a fusão do gelo é exatamente a quantidade de energia disponível no sistema, sendo assim, o gelo irá derreter consumindo todo o calor disponível, restando apenas 1500 g de água líquida em equilíbrio térmico dentro do calorímetro.
Para confirmarmos o resultado, podemos escrever a equação do balanço energético, se o resultado for nulo, significa que o equilíbrio térmico foi atingido.
Q_{mbox{cedido}} + Q_{mbox{recebido}} = Q_1+Q_2+Q_3 = 2,000-10,000+8,000 = 0
Como o resultado obtido é zero, o equilíbrio térmico foi atingido.
1874) Uma pessoa mede a temperatura do motor de um carro pela manhã, antes de ligá-lo, e constata que é o mesmo valor da temperatura ambiente de 25ºC. Após colocar o motor para funcionar, a pessoa mede a temperatura novamente e registra o valor de 194ºF. A variação de temperatura sofrida pelo motor foi de:
- A) 338 K
- B) 169º F
- C) 117º C
- D) 65 K
Resposta: A alternativa correta é D) 65 K.
Para encontrarmos a variação de temperatura sofrida pelo motor, precisamos converter as temperaturas de Celsius para Kelvin. A temperatura ambiente é de 25°C, que equivale a 298 K. Após o motor começar a funcionar, a temperatura registra 194°F, que é igual a 357 K.
A variação de temperatura é dada pela diferença entre a temperatura final e a temperatura inicial:
ΔT = Tf - Ti = 357 K - 298 K = 59 K
No entanto, como a resposta é dada em Celsius, precisamos converter novamente:
ΔT = 59 K = 59 - 273,15 = 65 °C
Portanto, a variação de temperatura sofrida pelo motor foi de 65 K, que é a alternativa correta D).
1875) Em várias regiões com poucos recursos para a purificação da água, a fervura da água é o principal método para eliminar vírus, bactérias e parasitas. Considere que uma panela com um litro de água se encontra inicialmente à temperatura de 19,0 ºC. Uma fonte de calor fornece 180 calorias por segundo para a água. Durante o processo de aquecimento, a água perde 30,0 calorias por segundo para o ambiente. Em quanto tempo este volume de água irá atingir a temperatura de fervura? Dados: considere o calor específico da água igual a 1,00 cal/(g·ºC), sua densidade igual a 1,00 kg/L e a temperatura de ebulição da água no local igual a 100 ºC.
- A) 5,0 minutos
- B) 6,0 minutos
- C) 7,0 minutos
- D) 8,0 minutos
- E) 9,0 minutos
A alternativa correta é letra E) 9,0 minutos
Gabarito: LETRA E.
Sabemos que a potência útil absorvida pela água é dada pela razão entre o calor absorvido e o intervalo de tempo:
P_{útil} = dfrac { Q } { Delta t }
Assim, temos que:
P_{total} - P_{perdas} = dfrac { m cdot c cdot Delta theta } { Delta t }
Sendo d a densidade e V o volume de água, temos que:
P_{total} - P_{perdas} = dfrac { d cdot V cdot c cdot Delta theta } { Delta t }
Delta t = dfrac { d cdot V cdot c cdot Delta theta } { P_{total} - P_{perdas} }
Substituindo os valores do enunciado, temos que:
Delta t = dfrac { 1000 cdot 1 cdot 1 cdot left( 100 - 19 right) } { 180 - 30 }
Delta t = 540 , s =9 , min
Portanto, a resposta correta é a alternativa (e).
1876) Uma pessoa coloca um pedaço de presunto e um pedaço de queijo com a mesma temperatura inicial num forno de micro-ondas. Ela liga o forno por alguns segundos, de modo que o presunto e o queijo absorvem quantidades iguais de calor. Nem o presunto nem o queijo derretem nessa operação. A pessoa observa então que o pedaço de presunto ficou mais quente que o de queijo. Isso se deve ao fato de que:
- A) a capacidade térmica do presunto é maior que a do queijo.
- B) a capacidade térmica do presunto é menor que a do queijo.
- C) o calor latente do presunto é maior que o do queijo.
- D) o calor latente do presunto é menor que o do queijo.
- E) o coeficiente de dilatação térmica do presunto é maior que o do queijo.
A alternativa correta é letra B) a capacidade térmica do presunto é menor que a do queijo.
Gabarito: LETRA B.
Podemos relacionar a quantidade de calor absorvida Q e a variação da temperatura Delta T através da capacidade térmica C:
C = dfrac { Q } { Delta T }
Note que C e Delta T são inversamente proporcionais, de forma que, para uma mesma quantidade de calor absorvido, quanto maior a variação de temperatura, menor é a capacidade térmica.
Então, como o pedaço de presunto ficou mais quente que o de queijo, podemos afirmar que a capacidade térmica do presunto é menor que a do queijo.
Portanto, a resposta correta é a alternativa (b).
1877) Um comerciante tem um carro de última geração que possui um sensor que indica, com exatidão, o nível de combustível no tanque (feito de aço). Em uma manhã amena (15ºC), ele decide abastecer completamente o tanque de 40 L e o deixa estacionado no posto de gasolina. Após umas horas, ele retorna do seu negócio em um momento em que a temperatura estava marcando os 35º C.
- A) 1,14
- B) 3,60
- C) 3,42
- D) 1,20
- E) 3,78
A alternativa correta é letra C) 3,42
Como o coeficiente de dilatação linear do aço é maior do que o da gasolina, o tanque de combustível dilata mais do que a gasolina, fazendo seu aumento de volume ser maior do que o aumento do volume da gasolina.
Como o coeficiente de dilatação volumétrica é 3 vezes maior do que o coeficiente dilatação linear, então podemos escrever:
rho_{gas}=3alpha_{gas}
rho_{gas}=3times15times10^{-6}=45times10^{-6}
rho_{aço}=3alpha_{aço}
rho_{aço}=3times3times10^{-4}=9times10^{-4}
Incialmente, o tanque de gasolina foi completado, mas devido à variação de temperatura, o veículo acusou um "falso" esvaziamento ou enchimento a menor do tanque. Isso aconteceu devido à dilatação do tanque de combustível. Vejamos a variação de volumes da gasolina e do tanque:
Delta{V_{gas}}=V_0rhoDelta{T}
Delta{V_{gas}}=40times45times10^{-6}times20
Delta{V_{gas}}=36times10^{-3},L
Delta{V_{aço}}=V_0rhoDelta{T}
Delta{V_{aço}}=40times9times10^{-4}times20
Delta{V_{aço}}=72times10^{-2},L
A pergunta que devemos fazer é: Quantos litros de gasolina o tanque acusou a menos? A resposta é dada pela diferença entre as variações de volumes do aço e da gasolina:
Delta{V'}=Delta{V_{aço}}-Delta{V_{gas}}
Delta{V'}=72times10^{-2}-36times10^{-3}
Delta{V'}=0,684,L
Sendo assim, quantos reais cobrou (estorno) o comerciante do frentista se o litro de combustível estava R$5,00? Vejamos:
boxed{Valor,,cobrado=0,684times5=3,42,$}
Gabarito: C
1878) No interior de um calorímetro de capacidade térmica desprezível há uma pedra de gelo a 0 ºC. Injetam-se no calorímetro 5 g de vapor d´água a 100 ºC.
- A) 15 g
- B) 20 g
- C) 30 g
- D) 40 g
- E) 60 g
A alternativa correta é letra D) 40 g
Gabarito: LETRA D.
Para que ao ser atingido o equilíbrio térmico em seu interior o calorímetro contenha apenas água na fase líquida, a máxima massa da pedra de gelo é tal que o calor absorvido durante a fusão de toda pedra de gelo seja igual ao calor cedido durante a condensação de toda massa de vapor, somada ao calor cedido durante o resfriamento dessa massa de água condensada até 0°C. Assim, temos que:
m_{gelo} cdot L_{gelo} = m_{vapor} cdot L_{vapor} + m_{vapor} cdot c_{água} cdot Delta theta_{água}
m_{gelo} cdot 80 = 5 cdot 540 + 5 cdot 1 cdot left( 100 - 0 right)
m_{gelo}= dfrac { 3200 } { 80 }
m_{gelo}= 40 , g
Portanto, a resposta correta é a alternativa (d).
1879) Uma candidata à vacina contra a Covid-19 é mais de 90% eficaz na prevenção à doença. Contudo, ela precisa ser armazenada e transportada a uma temperatura igual ou inferior a 193 K. Quanto é a temperatura máxima de armazenamento desta vacina na escala Celsius?
- A) –50
- B) –60
- C) –70
- D) –80
- E) –90
A alternativa correta é letra D) –80
Vejamos a fórmula que relaciona as temperaturas nas escalas Celsius e Kelvin:
K=C + 273
193=C + 273
boxed{C= - 80}
Analisemos as alternativas:
Quanto é a temperatura máxima de armazenamento desta vacina na escala Celsius?
a) –50
b) –60
c) –70
d) –80. Esse é o gabarito.
e) –90
Gabarito: D
1880) autoclave hospitalar é um equipamento usado para esterilizar instrumentais e materiais de uso em hospitais e clínicas. Este equipamento utiliza vapor de água em alta temperatura e alta pressão para destruir agentes patogênicos. Uma autoclave encontra-se inicialmente à temperatura Ti = 100 °C e pressão atmosférica pi = 1,01 Pa. O processo de aquecimentoocorre até a pressão final pf = 1,07 Pa. Considerando o vapor de água como um gás ideal, calcule a temperatura final do processo.
- A) 107 °C
- B) 122 °C
- C) 137 °C
- D) 142 °C
- E) 157 °C
A alternativa correta é letra B) 122 °C
Para os gases ideais, temos a seguinte equação:
frac{P_1cdot V}{T_1}=frac{P_2cdot V}{T_2}tag 1
No nosso problema, o volume se mantém constante com o aquecimento e a temperatura é medida em Kelvin. Então teremos:
T_K = C + 273
T_{K1} = C + 273
T_{k1} = 100 + 273 = 373
Agora vamos substituir os valores dados na equação (1):
frac{1,01cdot bcancel{V}}{373}=frac{1,07cdot bcancel{V}}{T_{k2}}
T_{k2}=frac{1,07times 373}{1,01}=395
Agora passemos o valor da temperatura T_{k2} para Celsius:
395 = C + 273
boxed{C = 122,^oC}
Analisando todas as alternativas, concluímos que o nosso gabarito é a letra B.
Gabarito: B
