Questões Sobre Termologia - Física - concurso
1921) Uma sala tem 3m x 4m e o teto está a uma altura de 2m. Considere a densidade do ar 1,2 kg/m3 e o calor específico de cerca de 1,0 J/gK.
- A) 28,8 J
- B) 288 J
- C) 288 kJ
- D) 2,88 MJ
A alternativa correta é letra C) 288 kJ
A quantidade de calor retirada do ar é dada por:
Q = m c Delta theta
Em que m é a massa de ar, c é o calor específico, e Delta theta é variação de temperatura.
A massa do ar é obtida multiplicando a densidade pelo volume, e o volume de ar é a de um paralelepípedo de dimensões 3x4x2. A massa de ar vale:
1,2 times 3 times 4 times 2 = 28,8 kg.
A variação de temperatura é de Delta theta = 10^circ = 10 ~K.
O calor específico é de 1 J/gK. Veja que a unidade de massa está em gramas. Alteramos para quilogramas assim:
c = dfrac{1 ~J}{g ~K} times dfrac{1.000g}{1~ kg} = dfrac{1.000 ~J}{kg ~K}
Substituindo os valores:
Q = m c Delta theta
Q = 28,8 times 1.000 times 10 = 288.000 J.
Gabarito: Letra C.
1922) Para dar conta de evitar danos estruturais em construções devido à dilatação térmica de peças e elementos, são empregadas as chamadas juntas de dilatação. Um tipo comum é a chamada junta serrada, que é a separação das peças por um vão – comum em pavimentos de concreto e pontes. Os coeficientes de dilatação térmica do aço e do concreto são bastante próximos, e a NBR6118 recomenda o uso do coeficiente alpha = 10^{-5} /ºC para o concreto armado.
- A) 0,8 m
- B) 8 cm
- C) 8 m
- D) 8mm
A alternativa correta é letra D) 8mm
A variação do comprimento é dada por:
Delta L = L_0 times alpha times Delta theta
O comprimento inicial L_0 é de 40 m, e a variação de temperatura é de 20^circ, já que, da temperatura de 19,5o C, pode aumentar e pode diminuir de 10o C. Então, ficamos com:
Delta L = 40 times 10^-5 times 20 = 0,008 ~m = 8 ~mm
Gabarito: Letra D.
Questão 1923
A menor é de alumínio, cujo coeficiente de dilatação linear é αAl=22.10-6 oC-1, e tem, à temperatura ambiente, uma altura h, como mostra a figura.
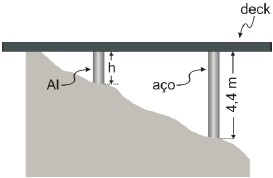
Para que o deck permaneça na horizontal seja qual for a variação de temperatura ocorrida, o comprimento h da coluna de alumínio à temperatura ambiente deve ser de
- A) 1,8 m.
- B) 2,0 m.
- C) 2,4 m.
- D) 2,8 m.
- E) 3,2 m.
A alternativa correta é letra C) 2,4 m.
Para que o deck permaneça na horizontal seja qual for a variação de temperatura ocorrida, a dilatação térmica sofrida pela coluna de alumínio (Delta L_{al}) deve ser igual à dilatação térmica sofrida pela coluna de aço (Delta L_{aço}).
Delta L_{al} = Delta L_{aço}
(L_0 cdot alpha cdot Delta theta)_{al}=(L_0 cdot alpha cdot Delta theta)_{aço}
Onde (alpha) é o coeficiente de dilatação linear, (L_0) o comprimento inicial da coluna e (Delta theta) a variação de temperatura. Como ambas as colunas estão no mesmo ambiente, a variação de temperatura sofrida por elas será a mesma, sendo assim podemos simplificar a expressão acima:
(L_0 cdot alpha cdot cancel{Delta theta})_{al}=(L_0 cdot alpha cdot cancel{Delta theta})_{aço}
Substituindo os dados do enunciado:
(L_0 cdot alpha)_{al}=(L_0 cdot alpha )_{aço}
h cdot 22 times 10^{-6}=4,4 cdot 12 times 10^{-6}
h cdot 22 times cancel{10^{-6}}=4,4 cdot 12times cancel{10^{-6}}
22h = 4,4 cdot 12
h= dfrac{4,4 cdot 12}{22}
Podemos notar que o numerador e o denominador são múltiplos de 2,2 , sendo assim podemos simplificar para facilitar os cálculos:
h= dfrac{cancelto{2}{4,4} cdot 12}{cancelto{10}{22}}=dfrac{2 cdot 12}{10}
h=dfrac{24}{10}
bbox[8px, border: 2px solid #3498db]{color{#3498db}{h=2,4 , m}}
Logo, o comprimento da coluna de alumínio à temperatura ambiente deve ser color{#3498db}{h=2,4,m}.
1924) Dois grupos de estudantes recebem a tarefa de medir, no laboratório do colégio, o calor específico de um metal. Para isso, recebem duas amostras de massas iguais desse metal e as aquecem em água fervente até terem certeza de que suas temperaturas chegaram a 100oC. Um dos grupos utiliza um calorímetro de água (Berthelot), coloca no calorímetro 800 g de água a 20oC e nele introduz uma das amostras metálicas aquecida. O outro grupo usa um calorímetro do “poço de gelo” (Bunsen), coloca no calorímetro uma grande pedra de gelo a 0oC, que possui uma cavidade (o “poço”) e nessa cavidade introduz a outra amostra metálica aquecida e, em seguida, o tampa. O calor específico da água (líquida) é 1,0 cal/goC e o calor latente de fusão do gelo é 80 cal/g. Considere desprezíveis as capacidades térmicas dos calorímetros. O grupo que utilizou o calorímetro de Berthelot verificou que a temperatura de equilíbrio térmico do sistema água/amostra metálica foi de 36oC.
- A) 160 g.
- B) 200 g.
- C) 250 g.
- D) 300 g.
- E) 320 g.
A alternativa correta é letra C) 250 g.
Suponha que a massa do metal seja igual a m. Pelo princípio geral das trocas de calor teremos:
Q_{metal} + Q_{água} = 0 tag 1
Onde a quantidade de calor Q é igual a:
Q=mcdot ccdotDelta{theta}
Então iremos primeiramente aplicar esta equação à situação do grupo que utilizou o calorímetro de Berthelot:
m_{metal}cdot c_{metal}cdot (36 - 100) + 800cdot 1cdot (36 - 20) = 0
m_{metal}cdot c_{metal}cdot (-64) + 12800 = 0
12800=64cdot m_{metal}cdot c_{metal}
m_{metal}cdot c_{metal}=200
Na outra situação, a massa m do mesmo metal a mesma de temperatura de 100oC trocará calor com o gelo a 0oC até que ocorra a fusão parcial da massa de gelo.
Devemos nos lembrar que não ocorre mudança de temperatura do gelo no processo de fusão. A massa de metal aquecida trocará calor com o gelo até atingir o equilíbrio térmico. Então teremos:
Q_{metal} + Q_{gelo} = 0
m_{metal}cdot c_{metal}cdot Delta{theta} + m_{gelo}cdot L = 0
-100cdotcancelto{200}{m_{metal}cdot c_{metal}} + m_{gelo}cdot 80 = 0
m_{gelo}cdot 80 = 20000
boxed{m_{gelo} = 250,g}
Portanto, a massa de gelo que será possível fundir com a massa de metal aquecida será de 250g. Assim concluímos que o gabarito é a letra B.
Gabarito: B
Questão 1925
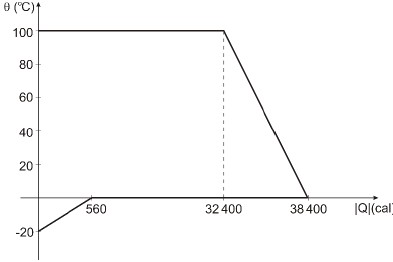
O calor específico a água (líquida) é 1,0 cal/goC e o calor latente de fusão do gelo é 80 cal/g. Ao ser atingido o equilíbrio térmico, a massa de água na fase líquida contida no calorímetro é
- A) 620 g.
- B) 560 g.
- C) 500 g.
- D) 470 g.
- E) 410 g.
ESTA QUESTÃO FOI ANULADA, NÃO POSSUI ALTERNATIVA CORRETA
O valor de água cede calor para o gelo, até que o sistema alcance o equilíbrio a mesma temperatura. Na fase inicial, o vapor de água se condensa até que toda a massa se torne água líquida. Durante este processo de condensação, que ocorre a temperatura constante de 100oC, a quantidade de calor latente cedida pelo vapor de água é:
Q=mL
Observação: O calor latente de condensação do vapor de água é de 540Cal/g. Essa informação não foi dada no enunciado.
Pelo gráfico do problema, notamos que os vapores de água cederam 32400 Calorias até se completar o processo de condensação. Logo,
32400=m_1times540
m_1=frac{32400}{540}
m_1=50g
Por outro lado, temos o gelo que receberá calor, elevando sua temperatura de -20oC a 0oC, depois teremos a fase do gelo a 0oC e por fim a fase em que todo o gelo se transforma em água a 0oC, prosseguindo na elevação de temperatura até que ocorra o equilíbrio térmico. Assim, percebe-se que são de três fases.
Aqui ocorre um outro problema dessa questão: não foi informado o calor específico do gelo, que é de 0,5Cal/g.
1. Pelo gráfico, o gelo está inicialmente a -20oC. Logo, usaremos a fórmula do calor do sensível para o gelo:
Q=mcdot ccdot Delta{theta}
560=m_2cdot 0,5cdot(0 - (-20))
m_2=frac{560}{10}=56g
2. Agora sabemos que são 56g de gelo a 0oC que receberão calor latente de fusão até que se transforme em água a 0oC:
Q=mL
Q=56times80
Q=4480 ,Cal
3. A partir dessa fase, temos 56g de água a 0oC e qualquer quantidade de calor recebida fará com que a massa de água eleve sua temperatura. Para obtermos 56g de água a 0oC a partir do gelo -20oC foram necessários 4480 Cal + 560 Cal = 5040 Cal.
Percebemos que tantos as massas de vapores de água e gelo envolvidas como as próprias informações do gráfico para equilíbrio térmico não são coerentes.
Portanto, a questão de fato mereceu anulação.
Gabarito: Anulada
1926) Um negociante comprou 25000 barris de petróleo na Sibéria, a -5oC, pagando 78 dólares por barril, para revendê-lo à Nicarágua. Em lá chegando, soube que, em virtude da crise, o preço do petróleo estava em baixa.
- A) 45oC.
- B) 40oC.
- C) 35oC.
- D) 30oC.
- E) 25oC.
A alternativa correta é letra C) 35oC.
Vamos inicialmente calcular o preço de custo. Foram adquiridos 25000 barris de petróleo ao custo unitário de $78 dólares. Então o custo:
mbox{Custo: } 25,000 times $78 = $, 1,950,000
Como o valor de venda foi o mesmo do custo (não houve lucro nem prejuízo), vamos encontrar o volume de petróleo (V) em barris, vendido no valor de $75 dólares a unidade:
mbox{Venda: } $, 1,950,000 = V times $75 ,,, implies ,,, V = dfrac{1,950,000}{75} = 26,000 mbox { barris}
Sendo assim, a variação de volume (Delta V) sofrida pelo petróleo devido à dilatação volumétrica foi:
Delta V = V-V_0 = 26,000-25,000
Delta V= 1,000 mbox{ barris}
Aplicando a equação da dilatação volumétrica:
Delta V = gamma cdot V_0 cdot Delta theta
1,000 = (1 times 10^{-3}) cdot 25,000 cdot Delta theta
1,000 = (1 times cancel{10^{-3}}) cdot 25cancel{000} cdot Delta theta
1,000 = 25 Delta theta
Delta theta = dfrac{1,000}{25}
Delta theta = 40^circ C ,,, implies mbox{ Variação de temperatura}
Como a temperatura inicial (na Sibéria) era -5^circ C, temos:
Delta theta = theta_f - theta_i ,,, implies ,,, theta_f = Delta theta + theta_i
theta_f = 40 - 5
theta_f = 35^circ C
Portanto, a temperatura na qual o petróleo foi revendido na Nicarágua foi de color{#3498db}{35^circ C}.
Questão 1927
O coeficiente de dilatação do mercúrio é gamma_{Hg}= 181.10-6 oC-1, enquanto o coeficiente de dilatação linear do vidro é αV = 7.10-6 oC-1.
O acréscimo Δθ ocorrido na temperatura do conjunto foi de
- A) 25oC.
- B) 30oC.
- C) 50oC.
- D) 60oC.
- E) 75oC.
A alternativa correta é letra E) 75oC.
A quantidade de líquido que transbordou, chamada de dilatação aparente (Delta V_{ap}), não é igual a dilatação real do líquido (Delta V_{r}), pois o frasco também sofre dilatação (Delta V_{f}). Sendo assim, podemos relacionar o coeficiente de dilatação volumétrica aparente (gamma_{ap}) com os coeficientes de dilatação volumétrica do mercúrio (gamma_{r}) e do vidro (gamma_{f}):
gamma_{ap}=gamma_{r}-gamma_{f} tag{1}
No exercício foi fornecido o coeficiente de dilatação linear do vidro (alpha_V). Sabendo que para um mesmo material gamma = 3times alpha, temos:
gamma_{f} = 3 times alpha_V
gamma_{f} = 3 times 7 times 10^{-6}
gamma_{f} = 21 times 10^{-6}
Substituindo os valores na Expressão (1), temos:
gamma_{ap}=181 times 10^{-6}-21times 10^{-6}
gamma_{ap}=160 times 10^{-6}
Aplicando a equação de dilatação volumétrica:
Delta V_{ap} = gamma_{ap} cdot V_0 cdot Delta theta
0,6 = (160times 10^{-6}) cdot 50 cdot Delta theta
0,6 = 8,000 times 10^{-6} cdot Delta theta
0,6 = 8cancel{000} times cancelto{10^{-3}}{10^{-6}} cdot Delta theta
0,6 = 8 times 10^{-3} cdot Delta theta
Delta theta = dfrac{0,6}{8 times 10^{-3}} = dfrac{0,6 times 10^3}{8} = dfrac{600}{8}
Delta theta = 75^circ C
Portanto, o acréscimo na temperatura do conjunto foi de color{#3498db}{75^circ C}.
1928) Um calorímetro de capacidade térmica desprezível contém uma pedra de gelo a 0 oC. Injetam-se no calorímetro 50 g de vapor d’água a 100 oC. Considere o calor latente de condensação do vapor dágua igual a 540 cal/g, o calor latente de fusão do gelo igual a 80 cal/g e o calor específico da água (líquida) igual a 1 cal/goC.
- A) 400 g.
- B) 320 g.
- C) 240 g.
- D) 160 g.
- E) 120 g.
A alternativa correta é letra A) 400 g.
Vamos imaginar que uma pequena porção de gelo seja adicionada ao calorímetro. Assim o vapor irá fornecer calor para o gelo que irá derreter e aumentar sua temperatura até atingir o equilíbrio térmico com o vapor.
Se adicionarmos uma porção muito grande de gelo, o calor cedido pelo vapor, não será suficiente para fundir todo o gelo e no equilíbrio restará água e gelo em equilíbrio a 0^circ C.
Para que o sistema, ao atingir o equilíbrio, não contenha mais gelo, o vapor terá que se transformar em água líquida à temperatura de 0^circ C (pois se a temperatura atingida fosse maior significaria que uma massa maior de gelo poderia ter sido colocada no calorímetro) e todo o gelo deve ter se transformado em água. Sendo assim podemos montar o equilíbrio térmico:
Q_{gelo}+Q_{vapor}=0
(m cdot L_f)_{gelo}+ (mcdot L_c+m cdot c cdot Delta theta)_{vapor} = 0
(m cdot 80)_{gelo}+[(50cdot (-540)+50 cdot 1 cdot (0-100)]_{vapor} = 0
80 m_{gelo}- 27,000 -5,000 = 0
80m_{gelo}=32,000
m_{gelo}=dfrac{32,000}{80}=dfrac{cancelto{4,000}{32,000}}{cancelto{10}{80}}=dfrac{4,000}{10}
bbox[8px, border: 2px solid black]{color{black}{m_{gelo}=400,g}}
Portanto, a massa inicial da pedra de gelo pode valer no máximo 400 g para que o equilíbrio térmico seja atingido e não reste mais gelo no calorímetro.
1929) Uma máquina térmica absorve calor de 105 kcal de uma fonte, que está a 127ºC e rejeita uma parte do calor para chegar a 27ºC. Calcule a eficiência e do motor e o trabalho realizado W por ele e assinale a alternativa correta.
- A) e = 10% ; 2,05 . 108 J
- B) e = 2% ; 3,75 . 108 J
- C) e = 90% ; 10,50 . 108 J
- D) e = 25% ; 1,05 . 108 J
- E) e = 35% ; 9,72 . 108 J
A alternativa correta é letra D) e = 25% ; 1,05 . 108 J
Pessoal, a eficiência é calculada por
eta = 1 - dfrac{T_F}{T_Q}
eta = 1 - dfrac {300}{400} = 0,25
Isso equivale a 25%.
Agora, o trabalho
Gabarito: LETRA D.
1930) Ao tocarmos um piso de madeira, temos a sensação de que este é mais quente que o piso de ladrilho. É correto afirmar que isso ocorre porque
- A) o pé e o ladrilho não trocam calor, visto que a madeira estoca calor.
- B) o pé e o ladrilho trocam calor muito mais rapidamente do que o pé e a madeira, pois a madeira é um mau condutor de calor.
- C) o pé e o ladrilho trocam calor muito mais lentamente do que o pé e a madeira, pois o ladrilho e a madeira são mais condutores de calor.
- D) o pé e o ladrilho trocam calor muito mais rapidamente do que o pé e a madeira, visto que a madeira é um bom condutor de calor.
- E) o pé e o ladrilho trocam calor muito mais rapidamente do que o pé e a madeira, visto que a madeira é um grande produtor de entropia.
A alternativa correta é letra B) o pé e o ladrilho trocam calor muito mais rapidamente do que o pé e a madeira, pois a madeira é um mau condutor de calor.
Pessoal, a sensação de "calor" ou "frio" tem a ver com o fluxo de calor.
Isso significa que mesmo materiais a uma mesma temperatura vão apresentar sensações diferentes.
A temperatura influi também. Porém mesmo a uma mesma dada temperatura teremos sensações térmicas diferentes ao tocarmos materiais diferentes.
Diante do exposto, nosso gabarito é a LETRA B.
Gabarito: LETRA B.
