Questões Sobre Termologia - Física - concurso
1981) Um experimento, realizado na altitude do mar, busca determinar a potência elétrica dissipada por um condutor; para isso ligase esse condutor aos polos de uma fonte de tensão de 100 V. Colocando-o dentro de um recipiente com 0,5 kg de água inicialmente a 20° C, o condutor libera calor, por conta do efeito joule, e a água começa a esquentar atingindo o ponto de ebulição após 8 minutos. Dado o calor específico da água igual a 4 J/g° C, desconsiderando-se as trocas de calor com o ambiente externo, a potência dissipada pelo condutor é de, aproximadamente:
- A) 200 W
- B) 333 W
- C) 450 W
- D) 533 W
Para resolver esse problema, devemos aplicar o conceito de calor específico. O calor específico é a quantidade de calor necessária para elevar a temperatura de 1 g de uma substância em 1°C. No caso da água, o calor específico é de 4 J/g°C.
Primeiramente, é preciso calcular a variação de temperatura da água. A água inicialmente está a 20°C e atinge o ponto de ebulição (100°C) após 8 minutos. Portanto, a variação de temperatura é de 80°C.
Em seguida, devemos calcular a quantidade de calor necessário para elevar a temperatura da água de 20°C para 100°C. Como a massa de água é de 0,5 kg = 500 g, a quantidade de calor necessário é:
$$Q = m cdot c cdot Delta T = 500 text{ g} cdot 4 frac{text{J}}{text{g°C}} cdot 80°C = 160000 text{ J}$$
Como o condutor libera calor por conta do efeito Joule, a potência dissipada pelo condutor é a razão entre a quantidade de calor liberada e o tempo:
$$P = frac{Q}{t} = frac{160000 text{ J}}{8 text{ min}} = frac{160000 text{ J}}{480 text{ s}} = 333,33 text{ W}$$
Portanto, a alternativa correta é a letra B) 333 W.
Explicação:
A resposta correta é a letra B) 333 W porque calculamos a quantidade de calor necessário para elevar a temperatura da água de 20°C para 100°C e, em seguida, calculamos a potência dissipada pelo condutor, que é a razão entre a quantidade de calor liberada e o tempo.
1982) A luminosidade L de uma estrela está relacionada com o raio R e com a temperatura T dessa estrela segundo a Lei de Stefan-Boltzmann: L = c ⋅ R2 ⋅ T4 , em que c é uma constante igual para todas as estrelas.
- A) LE = frac{L_F}{2}
- B) LE = frac{L_F}{4}
- C) LE = LF
- D) LE = 4LF
- E) LE = 8LF
A alternativa correta é letra D) LE = 4LF
Vamos chamar o raio da estrela E de R_e... E, a temperatura da estrela E de T_e... Da mesma forma, vamos chamar o raio da estrela F de R_f... E, a temperatura da estrela F de T_f...
Agora, sabemos que a estrela E tem a metade do raio da estrela F... Então,
R_e=dfrac {R_f}2
Também sabemos que a estrela E tem o dobro da temperatura da estrela F... Então,
T_e=2.T_f
Oras, sabemos que a luminosidade L de uma estrela está relacionada com o raio R e com a temperatura T dessa estrela segundo a Lei de Stefan-Boltzmann: L = ccdot R^2cdot T^4, em que c é uma constante igual para todas as estrelas...
Pronto!!... A relação entre as luminosidades das estrelas E e F é:
dfrac {L_e}{L_f}=dfrac {ccdot (R_e)^2cdot (T_e)^4}{ccdot (R_f)^2cdot (T_f)^4}
Substituindo os valores, teremos:
dfrac {L_e}{L_f}=dfrac {left (frac {R_f}2right )^2cdot (2.T_f)^4}{(R_f)^2cdot (T_f)^4}
dfrac {L_e}{L_f}=dfrac {frac {(R_f)^2}4cdot 16.(T_f)^4}{(R_f)^2cdot (T_f)^4}
dfrac {L_e}{L_f}=dfrac {4cdot cancel{(R_f)^2cdot (T_f)^4}}{cancel{(R_f)^2cdot (T_f)^4}}
dfrac {L_e}{L_f}=4
L_e=4cdot L_f
Letra D
1983) Sobre as mudanças do estado físico da água, é correto afirmar que:
- A) A solidificação ocorre por aumento da temperatura.
- B) A ebulição ocorre a 0ºC.
- C) A fusão ocorre a 100ºC.
- D) Durante a ebulição, a temperatura permanece constante.
- E) A mudança de um estado físico para outro depende, portanto, de temperatura e pressão.
Given that this question was annulled and does not have a correct alternative, we will explain the correct answer based on the principles of thermology.
The question is asking about the changes in the physical state of water. Let's analyze each alternative:
A) Solidification occurs due to an increase in temperature. This is incorrect. Solidification occurs when the temperature of water decreases to 0°C (at standard atmospheric pressure).
B) Boiling occurs at 0°C. This is also incorrect. Boiling occurs when the temperature of water reaches 100°C (at standard atmospheric pressure).
C) Fusion occurs at 100°C. This is incorrect as well. Fusion, also known as melting, occurs when the temperature of ice increases to 0°C (at standard atmospheric pressure).
D) During boiling, the temperature remains constant. This is correct! When water is boiling, the temperature remains constant at 100°C (at standard atmospheric pressure), as the heat energy is used to change the state of the water from liquid to gas.
E) The change of state depends on both temperature and pressure. This is correct as well! The change of state of a substance depends on both temperature and pressure. For example, the boiling point of water changes with pressure.
Therefore, if this question were not annulled, the correct answers would be D and E. However, since it was annulled, we cannot consider any of the alternatives as correct.
In conclusion, it's essential to understand the principles of thermology, including the changes of state of substances, to answer questions like this correctly. Remember, the temperature and pressure of a substance determine its physical state, and changes in these variables can cause changes in the state of the substance.
1984) Quatro mols de ar a temperatura de 27 °C e pressão de 200 kPa está dentro de um pistão cilíndrico capaz de se mover na vertical. O pistão é aquecido mediante pressão constante até a temperatura de 227 °C, após atingir essa temperatura o sistema dissipa calor mediante um processo a volume constante e, retorna ao estado inicial mediante uma compressão adiabática. Tomando c_p = 0,2frac {kJ} {kg.K}. e c_v = 0,1frac {kJ} {kg.K} bar{M}_{ar} = 29 g/mol
- A) 1008 J
- B) 412 J
- C) 928 J
- D) 346 J
- E) 15 J
ESTA QUESTÃO FOI ANULADA, NÃO POSSUI ALTERNATIVA CORRETA
Gabarito: ANULADA.
Observando o enunciado, podemos perceber que a questão está incompleta, por isso a anulação da mesma. Porém, analisando as alternativas, podemos inferir que a banca queria que o candidato encontrasse um valor de energia.
Assim, para efeitos didáticos, vamos analisar os processos termodinâmicos que ocorrem sobre o sistema da questão.
De acordo com o enunciado, podemos considerar que o gás se encontra em um estado 1, é aquecido a pressão constante até um estado 2, dissipa calor mediante um processo a volume constante até um estado 3 e retorna ao estado inicial 1 mediante uma compressão adiabática, como nos mostra o diagrama PV abaixo:
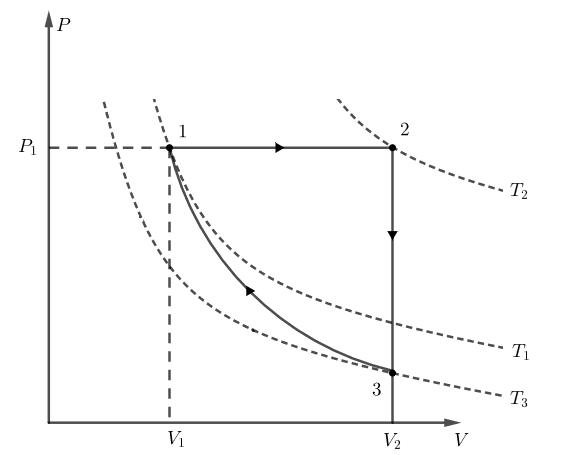
Aplicando a primeira lei da termodinâmica para o ciclo, podemos escrever:
Delta U_{ciclo} = Q_{ciclo} - W_{ciclo}
Como os estados final e inicial do ciclo são iguais, temos que Delta U_{ciclo} = 0. Logo,
0 = Q_{ciclo} - W_{ciclo}
W_{ciclo} = Q_{ciclo}
Ou seja, a soma do trabalho realizado pelo sistema é igual à soma do calor absorvido por ele.
A soma do calor absorvido pelo sistema é dado por:
Q_{ciclo} = Q_{1 rightarrow 2} + Q_{2 rightarrow 3} + Q_{3 rightarrow 1}
Porém, como o processo 3 rightarrow 1 é adiabático, temos que Q_{3 rightarrow 1} = 0. Logo,
Q_{ciclo} = Q_{1 rightarrow 2} + Q_{2 rightarrow 3} + 0
Q_{ciclo} = Q_{1 rightarrow 2} + Q_{2 rightarrow 3} tag 1
Como o processo 1 rightarrow 2 ocorre à pressão constante, e os valores de calor específico são dados em função da massa, o calor absorvido pelo sistema é dado por:
Q_{1 rightarrow 2} = n cdot overline {M_{ar}} cdot c_p cdot Delta T tag 2
Onde overline {M_{ar}} é a massa molar do gás, n é o número de mols do gás, c_p é o calor específico a pressão constante e Delta T é a variação de temperatura.
Do enunciado, temos que n = 4 , mols, overline{M_{ar}} = 29 , g/mol, c_p = 0,2dfrac {kJ} {kgcdot K}, T_1 = 27°C = 27 + 273 = 300 , K e T_2 = 227°C = 227 + 273 = 500 , K. Substituindo os valores na equação acima, temos:
Q_{1 rightarrow 2} = 4 cancel {mol} cdot 29dfrac { cancel g } { cancel {mol} } cdot 0,2dfrac { cancel k J}{ cancel k cancel g cdot cancel K} cdot left( 500 - 300 right) cancel K
Q_{1 rightarrow 2} = 4640, J
Como o processo 2 rightarrow 3 ocorre a volume constante, o calor dissipado pelo sistema é dado por:
Q_{2 rightarrow 3} = n cdot overline{M_{ar} } cdot c_v cdot Delta T
Onde c_v é o calo específico a volume constante. Logo,
Q_{2 rightarrow 3} = n cdot overline{M_{ar} } cdot c_v cdot left( T_3 - T_2 right) tag 3
Como não sabemos a temperatura T_3, vamos utilizar a relação entre a temperatura e o volume de uma transformação adiabática:
T_3 {V_3}^{gamma -1} = T_1 {V_1}^{gamma -1}
Onde gamma = dfrac { c_p } { c_v } = dfrac { 0,2 } { 0,1 } = 2. Logo,
T_3 {V_3}^{2 -1} = T_1 {V_1}^{2 -1}
T_3 {V_3} = T_1 {V_1}
T_3 = dfrac { V_1 } { V_3 } T_1
Porém, V_3 = V_2. Logo,
T_3 = dfrac { V_1 } { V_2 } T_1 tag 4
Entretanto, utilizando a Lei Geral dos Gases Ideais, podemos escrever:
dfrac { P_1 V_1 } { T_1 } = dfrac { P_2 V_2 } { T_2 }
Como P_1 = P_2
dfrac { cancel {P_1} V_1 } { T_1 } = dfrac { cancel {P_1} V_2 } { T_2 }
dfrac { V_1 } { T_1 } = dfrac { V_2 } { T_2 }
dfrac { V_1 } { V_2 } = dfrac { T_1 } { T_2 } tag 5
Substituindo (5) em (4), temos:
T_3 = dfrac { T_1 } { T_2 } T_1
T_3 = dfrac { {T_1}^2 } { T_2 }
Substituindo T_3 em (3), temos:
Q_{2 rightarrow 3} = n cdot overline{M_{ar} } cdot c_v cdot left( dfrac { {T_1}^2 } { T_2 } - T_2 right) tag 6
Substituindo os valores do enunciado, temos:
Q_{2 rightarrow 3} = 4 cdot 29 cdot 0,1 left( dfrac { 300^2 } { 500 } - 500 right)
Q_{2 rightarrow 3} = -3712 , J
O valor é negativo pois o sistema dissipa calor.
Então, substituindo Q_{2 rightarrow 3} e Q_{2 rightarrow 3} na equação (1), temos:
Q_{ciclo} = Q_{1 rightarrow 2} + Q_{2 rightarrow 3}
Q_{ciclo} = 4640 + left(-3712right)
Q_{ciclo} = 928 , J
Ou seja, a soma do calor recebido pela massa de ar no pistão é igual a 928 J.
Observando as alternativas, podemos verificar que há uma alternativa que corresponde ao valor que encontramos (letra c). Entretanto, a questão foi anulada.
1985)
- A) 0,04
- B) 0,06
- C) 0,40
- D) 0,60
- E) 0,80
A alternativa correta é letra A) 0,04
O fluxo de calor que flui por condução num material é dado pela Lei de Fourier:
Phi=frac{KADelta{T}}{L}
Onde K é a condutividade térmica do material, A é a área por onde flui o fluxo de calor e Delta{T} é o diferencial de temperatura entre os diferentes lados separados pelo material isolante e L é a espessura da placa.
Um outro conceito muito utilizado em transferência de calor é a resistência elétrica R. A resistência térmica é o inverso da condutância térmica. Assim como uma resistência elétrica está associada à condução de eletricidade, uma resistência térmica pode estar associada à condução de calor. A resistência térmica para condução em uma parede plana é definida como:
R=frac{L}{kA}
Assim, podemos escrever a equação de Fourier do seguinte modo:
Phi=frac{Delta{T}}{R}
Phi R=Delta{T}
Desse modo, podemos analisar o nosso problema de forma análoga à lei de Ohm em circuitos elétricos:
Delta{T}=RPhi longrightarrow V=R'i
Então, na primeira situação teremos o fluxo de calor por um material com diferença de temperaturas iguais a (TA1 - TB1) e resistência R_1:
Delta{T}=RPhitag 1
Obs: TB1 − TA1 = TP − TA2=Delta{T}
E para o segundo caso, como temos dois materiais condutores térmicos justapostos, logo, analogamente a resistores em série teremos:
Delta{T}=(R+R_p)0,4Phitag 2
Aqui podemos nos lembrar, por analogia, do que acontece em circuitos elétricos. Nessa segunda situação do circuito térmicos, quando a resistência aumenta, a "corrente elétrica" Phi diminui (Phi longrightarrow 0,4Phi).
Igualando (1) e (2):
RPhi=(R+R_p)0,4Phi
0,6R=0,4R_p
R=frac{2}{3}R_ptag 3
Entretanto, conforme vimos acima, a resistência térmica é dada por R=frac{L}{kA}. Logo, fazendo a substituição na equação (3):
frac{L_t}{k_tA}=frac{2}{3}frac{L_p}{k_pA}
frac{0,1}{k_t}=frac{2}{3}frac{0,006}{k_p}
boxed{frac{k_p}{k_t}=frac{2}{3}frac{0,006}{0,1}=0,04}
Gabarito: A
1986) Um estudante de Física resolveu criar sua própria escala termométrica e seu próprio termômetro. Para isso, utilizou um tubo de vidro contendo mercúrio. Ele tomou como pontos fixos o gelo fundente e a água em ebulição. Ao colocar o tubo em contato com o gelo fundente, e após esperar que fosse atingido o equilíbrio térmico, percebeu que a coluna de mercúrio atingia uma altura de 2 cm. Ele atribuiu o valor de 30º a essa temperatura. Repetindo o procedimento para a água em ebulição, viu que a coluna de mercúrio atingia uma altitude de 11 cm. Para a temperatura da água em ebulição atribuiu o valor de 120º. Sabendo que a relação entre a altura da coluna de mercúrio e a temperatura é uma função linear, qual temperatura corresponde a uma altura de 7 cm da coluna de mercúrio, na escala do estudante?
- A) 80 graus
- B) 95 graus
- C) 85 graus
- D) 90 graus
- E) 75 graus
A alternativa correta é letra A) 80 graus
Como existe uma relação direta entre a altura h da coluna de mercúrio e os limites de temperatura T atribuídos pelo estudante, então podemos fazer a seguinte relação:
frac{Delta{T}}{Delta{h}}=frac{120-30}{11-2}=frac{90}{9}=10
Então, podemos escrever a função:
T=10h+k
Onde k é uma constante que teremos que determinar a partir dos valores apresentados no enunciado. Considerando que a altura de 2 cm corresponde à temperatura de 30º:
T=10h+k
30=10times 2+k
boxed{k=10}
Escrevendo a função de temperatura:
T=10times h+10
Para uma altura de 7cm teremos:
T=10times 7+10
boxed{T=80^o}
Gabarito: A
1987) Você resolve cozinhar um delicioso macarrão para o almoço de domingo. Você dispõe de duas panelas de mesmo material, mas de massas diferentes. A massa da panela 1 é 50% maior que a da panela 2. Você vai utilizar 2 litros de água para cozinhar o macarrão. Considerando que você quer realizar esse objetivo no menor tempo possível, dentre as alternativas abaixo, marque aquela que representa a melhor escolha e a correta justificativa.
- A) Escolho a panela de massa m2 por que tem a menor capacidade térmica.
- B) Escolho a panela de massa m2 que tem a maior capacidade térmica.
- C) Escolho a panela de massa m1 por que tem a menor capacidade térmica.
- D) Escolho a panela de massa m1 por que tem a maior capacidade térmica.
- E) Escolho qualquer uma, pois o tempo de cozimento não depende da massa da panela.
A alternativa correta é letra A) Escolho a panela de massa m2 por que tem a menor capacidade térmica.
Como os volumes de águas serão os mesmos para as duas panelas, a diferença quanto ao tempo de cozimento se dará na diferença entre as panelas utilizadas.
A capacidade térmica (C), também chamada de capacidade calorífica, é uma grandeza que corresponde a quantidade de calor presente num corpo em relação à variação de temperatura sofrida por ele. É dada pela seguinte expressão:
C=frac{Q}{Delta{t}}
ou
C=mcdot c
Onde m é a massa da panela e c é o calor específico do material constituinte da panela. Como a massa da panela 1 é 50% maior que a da panela 2, então para uma massa maior, maior será o tempo necessário para variar sua temperatura em 1^o,C. Em outras palavras podemos dizer que a panela 1 tem maior capacidade térmica do que a panela 2, pois leva mais tempo para aquecer, quando absorve uma mesma quantidade de calor Q.
Sendo assim, para realizarmos o cozimento no menor tempo possível, o interessante é escolhermos a panela com a menor capacidade térmica, ou seja, a panela 2, pois a mesma apresentar uma elevação de temperatura num tempo menor.
Gabarito: A
1988) Os copos térmicos com tampa da marca S. funcionam como os calorímetros que são encontrados nos laboratórios de física. Um estudante que deseja resfriar 300 ml de água, adicionando pedras de gelo de 10 g cada, pode fazê-lo desprezando a perda de calor para o ambiente.
- A) 1
- B) 2
- C) 3
- D) 4
- E) 5
A resposta certa é a letra E) 5.
Para explicar essa resposta, vamos analisar o problema passo a passo. O estudante deseja resfriar 300 ml de água de 25°C para 10°C adicionando pedras de gelo de 10 g cada. Primeiramente, precisamos calcular a variação de temperatura da água, que é de 25°C - 10°C = 15°C.
Em seguida, vamos calcular a quantidade de calor necessária para resfriar a água. A fórmula para calcular a variação de energia é Q = mcΔT, onde m é a massa da água, c é o calor específico da água e ΔT é a variação de temperatura. Substituindo os valores, obtemos:
$$Q = 300 times 1 times 15 = 4500 cal$$
Agora, vamos calcular a quantidade de calor necessária para fundir as pedras de gelo. A fórmula para calcular a variação de energia é Q = mL, onde m é a massa da pedra de gelo e L é o calor latente de fusão. Substituindo os valores, obtemos:
$$Q = m times 80 = 80m cal$$
Como a quantidade de calor necessária para resfriar a água é igual à quantidade de calor necessária para fundir as pedras de gelo, podemos equacionar as duas expressões:
$$4500 = 80m$$
Dividindo ambos os lados por 80, obtemos:
$$m = frac{4500}{80} = 56,25 g$$
Como cada pedra de gelo tem 10 g, precisamos de:
$$frac{56,25}{10} = 5,625 pedras de gelo$$
Portanto, o estudante precisa de 5 pedras de gelo para resfriar a água.
1989) Enquanto os sistemas refrigeradores são caracterizados pela transferência ..I.. de calor desde uma fonte fria para uma fonte quente devido ao trabalho realizado ..II.. um gás no compressor, nas máquinas térmicas ocorre uma transferência de calor ..III.. da fonte quente para a fonte fria devido à realização de trabalho ..IV.. um gás que provoca o brusco deslocamento de um pistão. Uma consequência desta diferença entre esses dois tipos de aparelhos é que as representações das transformações gasosas em gráficos da pressão em função do volume, p x v, possuem sequências diferentes, sendo a expansão a alta pressão característica dos ciclos de sentido ..V.. das máquinas térmicas, ao passo que nos sistemas refrigeradores é a compressão que é feita a alta pressão, caracterizando ciclos de sentido ..VI.. .
- A)
não espontânea
por espontânea sobre horário anti-horário
- B)
espontânea
por não espontânea sobre anti-horário horário
- C)
espontânea
por não espontânea sobre horário anti-horário
- D)
não espontânea
sobre sobre por anti-horário horário - E)
não espontânea
sobre sobre por horário anti-horário
A alternativa correta é letra E)
não espontânea | sobre | sobre | por | horário | anti-horário |
Gabarito da banca: LETRA E.
Gabarito sugerido pelo professor: ANULADA.
De acordo com a segunda lei da termodinâmica, o calor flui espontaneamente do corpo mais quente para o mais frio. Como nas máquinas térmicas, o calor flui fonte quente para a fonte fria, esse processo ocorre de forma espontânea. O gás usado como meio de trabalho é aquecido na fonte quente, o que aumenta sua pressão e volume e, consequentemente, realiza trabalho ao empurrar um pistão ou executar outra forma de trabalho mecânico. Esse deslocamento do pistão é muitas vezes brusco e é o que gera a energia mecânica que pode ser usada para realizar tarefas úteis, como movimentar um veículo ou gerar eletricidade em uma usina.
No entanto, é importante observar que esse processo pode ser revertido em um sistema termodinâmico com a aplicação de trabalho externo sobre ele. É o que ocorre nos sistemas refrigeradores: o calor é transferido da fonte fria para a fonte quente de maneira não espontânea, graças ao trabalho realizado sobre o gás refrigerante no compressor.
Assim, podemos completar a lacuna I da seguinte maneira:
"Enquanto os sistemas refrigeradores são caracterizados pela transferência não espontânea de calor desde uma fonte fria para uma fonte quente devido ao trabalho realizado sobre um gás no compressor, nas máquinas térmicas ocorre uma transferência de calor espontânea da fonte quente para a fonte fria devido à realização de trabalho por um gás que provoca o brusco deslocamento de um pistão".
Para ilustrar as representações das transformações gasosas de uma máquina térmica em gráficos da pressão em função do volume, p x v, podemos utilizar o diagrama de uma máquina de Carnot, que consiste em duas transformações adiabáticas alternadas com duas transformações isotérmicas:
Fonte: HALLIDAY, DAVID (Fundamentos de física, volume 2 : Gravitação e Termodinâmica, 2016)
Note que a sequência de transformações em uma máquina de Carnot ocorre no sentido horário do diagrama p x v.
Para ilustrar as representações das transformações gasosas de sistemas refrigeradores, podemos escolher o refrigerador de Carnot, que consiste em uma máquina de Carnot operando no sentido inverso. Com isso, a sequência de transformações de um refrigerador em um diagrama p x v é exatamente igual ao anterior, exceto pelo fato de que o ciclo ocorre no sentido anti-horário.
Assim, podemos completar o restante das lacunas da seguinte maneira:
"Uma consequência desta diferença entre esses dois tipos de aparelhos é que as representações das transformações gasosas em gráficos da pressão em função do volume, p x v, possuem sequências diferentes, sendo a expansão a alta pressão característica dos ciclos de sentido horário das máquinas térmicas, ao passo que nos sistemas refrigeradores é a compressão que é feita a alta pressão, caracterizando ciclos de sentido anti-horário".
Então, os termos que completam corretamente as lacunas I, II, III, IV, V e VI do texto são, respectivamente:
| I | II | III | IV | V | VI |
não espontânea | sobre | espontânea | por | horário | anti-horário |
Portanto, como não há alternativa correspondente, a questão deveria ser ANULADA.
1990) No Ensino de Física é comum que o professor se depare com concepções alternativas construídas pelos alunos ao longo de sua vida e que por vezes se constituem como obstáculos para a aprendizagem de conceitos científicos. Particularmente ao ensino dos fenômenos térmicos, uma afirmação que expressa uma dessas concepções é:
- A) É impossível construir uma máquina térmica que funcione de modo contínuo, reutilizando a energia gerada por seu próprio movimento.
- B) Quanto mais quente está um corpo, mais agitadas estão suas partículas.
- C) Calor é energia térmica em trânsito entre corpos a diferentes temperaturas.
- D) Em dias frios utilizamos casacos para nos fornecer calor e nos manter aquecidos.
- E) O equilíbrio térmico entre dois corpos é atingido quando suas temperaturas se igualam.
A alternativa correta é letra D) Em dias frios utilizamos casacos para nos fornecer calor e nos manter aquecidos.
Gabarito: LETRA D.
Vamos analisar cada uma das alternativas:
a) É impossível construir uma máquina térmica que funcione de modo contínuo, reutilizando a energia gerada por seu próprio movimento.
Correta. Essa afirmação está relacionada à segunda lei da termodinâmica, que afirma que é impossível construir uma máquina térmica que funcione de modo contínuo, transformando completamente toda a energia térmica em trabalho útil, sem perda de energia. Isso é conhecido como o enunciado de Kelvin-Planck da segunda lei da termodinâmica.
b) Quanto mais quente está um corpo, mais agitadas estão suas partículas.
Correta. Quando um corpo é aquecido, sua energia interna aumenta, o que significa que as partículas que o compõem (como átomos ou moléculas) ganham energia cinética, que está associada ao movimento aleatório das partículas. Isso significa que, quanto mais quente está o corpo, mais rapidamente se movem as partículas.
c) Calor é energia térmica em trânsito entre corpos a diferentes temperaturas.
Correta. Calor é a transferência de energia térmica de um corpo para outro quando eles estão a diferentes temperaturas. De acordo com a segunda lei da termodinâmica, o calor flui espontaneamente do corpo com temperatura mais alta para o corpo com temperatura mais baixa.
d) Em dias frios utilizamos casacos para nos fornecer calor e nos manter aquecidos.
Incorreta. Casacos não fornecem calor por si mesmos, eles ajudam a reduzir a perda de calor corporal para o ambiente.
e) O equilíbrio térmico entre dois corpos é atingido quando suas temperaturas se igualam.
Correta. Quando dois corpos em contato direto trocam calor, o equilíbrio térmico é alcançado quando suas temperaturas se igualam. Isso é um princípio fundamental da termodinâmica e é conhecido como a lei zero da termodinâmica.
Portanto, a afirmação que expressa uma concepção que se constitui como obstáculos para a aprendizagem de conceitos científicos é a alternativa (d).
