Questões Sobre Termologia - Física - concurso
Questão 11
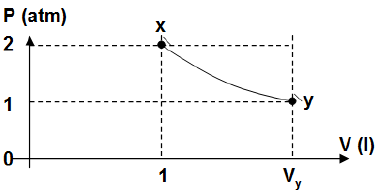
- A) Um litro e oito décimos.
- B) Dois litros.
- C) Um litro e seis décimos.
- D) Dois litros e dois décimos.
A alternativa correta é letra B) Dois litros.
De acordo com a lei geral dos gases ideais, temos a seguinte relação:
dfrac {P_x V_x}{T_x} = dfrac {P_y V_y}{T_y}
Como a transformação é isotérmica, temos que T_x = T_y. Logo,
P_x V_x = P_y V_y
Do gráfico, temos P_x = 2 atm, P_y = 1 atm, V_x = 1,0 l. Então:
2 cdot 1 = 1 cdot V_y
V_y = 2,0 l
Portanto, a resposta correta é a alternativa (B), dois litros.
12) Assinale a alternativa completa e correta, com base em seus conhecimentos de Termologia.
- A) Apenas a Pressão e a Temperatura são as variáveis de estado que caracterizam o estado de um gás perfeito.
- B) Apenas o Volume e a Temperatura são as variáveis de estado que caracterizam o estado de um gás perfeito.
- C) Apenas o Volume e a Pressão são as variáveis de estado que caracterizam o estado de um gás perfeito.
- D) Pressão, Volume e Temperatura são as variáveis de estado que caracterizam o estado de um gás perfeito.
A alternativa correta é letra D) Pressão, Volume e Temperatura são as variáveis de estado que caracterizam o estado de um gás perfeito.
Essa questão aborda a definição das variáveis de estado, que são grandezas físicas utilizadas para descrever um estado de um sistema termodinâmico. Dentre todas as variáveis de estados, podemos citar a temperatura, volume, pressão, entropia, massa, quantidade de matéria, entalpia e etc. Um gás perfeito é um sistema ideal que obedece a lei geral dos gases ideais, descrita na equação a seguir:
dfrac {PV}{T} = mathrm{constante}
Onde P é a pressão, V é o volume e T é a temperatura do sistema.
Assim, podemos afirmar que, para definir o estado de um gás perfeito, basta conhecermos as variáveis de estado Pressão, Volume e Temperatura.
Portanto, a resposta correta é a alternativa (D).
13) Uma determinada quantidade de um gás ideal ocupa um volume V0 a uma temperatura T0 sob pressão p0 e sofre uma transformação isobárica na qual seu volume final passa para 2V0. Indique o diagrama que melhor corresponde à transformação sofrida pelo gás.
- A)
- B)
- C)
- D)
- E)
Let's break down the problem step by step to understand why the correct answer is C.
The question states that a certain amount of an ideal gas occupies a volume V0 at a temperature T0 under pressure p0 and undergoes an isobaric transformation, of which the final volume becomes 2V0. We need to find the diagram that best corresponds to this transformation.
Firstly, let's recall the characteristics of isobaric transformations. In an isobaric process, the pressure remains constant. This means that the pressure of the system remains the same throughout the transformation, which is from V0 to 2V0.
Now, let's analyze the given diagrams. Diagram A shows a transformation where the volume increases, but the pressure also increases. This is not an isobaric process, so it cannot be the correct answer.
Diagram B shows a transformation where the volume decreases, and the pressure remains constant. However, the problem states that the final volume becomes 2V0, not less than V0. Therefore, this diagram is also not the correct answer.
Diagram C shows a transformation where the volume increases, and the pressure remains constant. This is an isobaric process, and the final volume becomes 2V0, which matches the problem statement. Therefore, the correct answer is C.
Diagrams D and E do not represent isobaric processes, so they cannot be the correct answers.
F and E are not isobaric processes either, so they cannot be the correct answers.
In conclusion, the correct answer is C because it is the only diagram that represents an isobaric process where the volume increases, and the pressure remains constant.
Questão 14
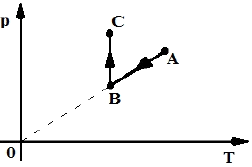
Indique o diagrama p-V que melhor corresponde às transformações do diagrama p-T dado.
- A)
- B)
- C)
- D)
- E)
Resposta:
A alternativa correta é a letra A).
Essa questão trata sobre as transformações de um gás perfeito em um diagrama p-T. O diagrama p-T é um gráfico que relaciona a pressão (p) e a temperatura (T) de um sistema termodinâmico.
No diagrama p-T fornecido, (mostrado acima), tem-se uma transformação isobárica (p constante) de A para B, seguida de uma transformação isocórica (V constante) de B para C.
Para encontrar o diagrama p-V que melhor corresponde às transformações do diagrama p-T, devemos analisar as características de cada transformação.
A transformação isobárica de A para B é representada por uma reta horizontal no diagrama p-V, pois a pressão é constante.
A transformação isocórica de B para C é representada por uma reta vertical no diagrama p-V, pois o volume é constante.
Logo, o diagrama p-V que melhor corresponde às transformações do diagrama p-T é a letra A.
Essa resposta é coerente com as características das transformações isobáricas e isocóricas em diagramas p-V.
15) Um gás ideal na temperatura T0 e pressão inicial p0, sofre uma transformação isotérmica na qual seu volume passa de V0 para 2V0. Determine o calor recebido pelo sistema.
- A)
nR,T_0,In,2
- B)
{ large nR over T_0} In,2
- C)
nR,p_0,In,2
- D)
nR,V_0,In,2
- E)
{ large nR over p_0} In,2
A resposta correta é a letra A).
$$Delta U = nR ln frac{V_f}{V_i} = nR ln frac{2V_0}{V_0} = nR ln 2$$
Since the internal energy variation is equal to the heat received (Q), we have:
$$Q = Delta U = nR ln 2$$
Therefore, the correct answer is A) nR ln 2.
Questão 16
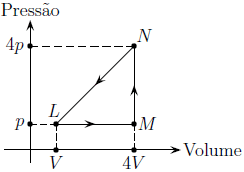
- A) 30pV
- B) 51pV/2
- C) 8pV
- D) 15pV/2
- E) 9pV/2
ESTA QUESTÃO FOI ANULADA, NÃO POSSUI ALTERNATIVA CORRETA
De acordo com o diagrama PxV, o ciclo é realizado no sentido anti-horário. Dessa forma, o gás recebe trabalho externo e absorve calor da fonte fria e cede calor à fonte quente, funcionando como um refrigerador. Por isso, a questão foi anulada.
Se considerarmos que Q_1 é a quantidade de calor absorvida, podemos afirmar que Q_1 é responsável pelo processo L rightarrow M rightarrow N. Assim, temos:
Delta U_{L rightarrow M rightarrow N} = Q_{1} - W_{L rightarrow M rightarrow N}
Delta U_{L rightarrow M rightarrow N} = Q_{1} - W_{L rightarrow M rightarrow N}
Para um gás monoatômico, temos que:
Delta U = dfrac {3 nR Delta T }{2}
Então,
Delta U_{L rightarrow M rightarrow N} = Q_{1} - W_{L rightarrow M rightarrow N}
dfrac {3 nR (T_N - T_L) }{2} = Q_{1} - (4V -V)cdot p
dfrac {3 nR (T_N - T_L) }{2} = Q_{1} - 3pV
De acordo com a lei geral dos gases ideais, temos:
dfrac {P_N V_N}{T_N} =dfrac {P_L V_L}{T_L}
dfrac {4p cdot 4V}{T_N} =dfrac {p V}{T_L}
T_N = 16 T_L
Então,
dfrac {3 nR (16 T_L - T_L) }{2} = Q_{1} - 3pV
dfrac {3 nR (16 T_L - T_L) }{2} = Q_{1} - 3pV
dfrac {3 nR (15 T_L ) }{2} = Q_{1} - 3pV
dfrac {45 nR T_L }{2} = Q_{1} - 3pV
Como P_L V_L = nrT_L, temos:
dfrac {45 P_L V_L }{2} = Q_{1} - 3pV
dfrac {45 pV }{2} = Q_{1} - 3pV
Q_{1} = dfrac {45 pV }{2} + 3pV
Q_{1} = dfrac {51pV }{2}
Portanto, a quantidade de calor absorvida é dfrac {51pV }{2}.
Resposta: anulada.
17) Uma amostra de um gás ideal sofre uma compressão isotérmica. Essa amostra, portanto,
- A) ganha calor da vizinhança.
- B) perde calor para a vizinhança.
- C) está a mesma temperatura da vizinhança.
- D) está a uma temperatura menor que a vizinhança.
Resposta: B) perde calor para a vizinhança.
Explicação: Durante uma compressão isotérmica, a temperatura do sistema não muda. Isso significa que a temperatura do gás ideal permanece constante. Como a compressão é isotérmica, não há variação de temperatura, portanto, o gás não pode ganhar ou perder calor. No entanto, para que a compressão seja possível, é necessário que o gás perca calor para a vizinhança, pois, caso contrário, o gás se expandiria e não seria possível comprimi-lo. Além disso, se o gás ganhasse calor, sua temperatura aumentaria, o que não é possível em uma compressão isotérmica.
Portanto, a alternativa correta é B) perde calor para a vizinhança, pois é a única maneira de realizar uma compressão isotérmica.
Questão 18
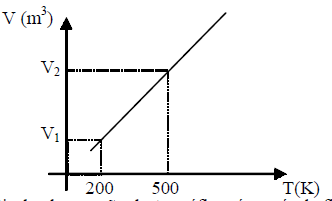
A partir da observação deste gráfico, é possível afirmar que:
- A)
V_1 = 3V_2
- B)
V_2 = 5V_1
- C)
V_1 = { large 5 over 2} V_2
- D)
V_1 = { large 2 over 5} V_2
A partir da observação do gráfico, apresentado, é possível afirmar que a transformação isobárica que ocorreu na massa de gás ideal é uma expansão, pois a temperatura é diretamente proporcional à pressão e inversamente proporcional ao volume.
Portanto, a alternativa correta é a letra D) V_1 = frac{2}{5} V_2, pois essa é a única opção que apresenta a relação correta entre os volumes inicial e final.
Essa resposta é justificada pela equação de estado dos gases ideais, que é dada por PV = nRT, onde P é a pressão, V é o volume, n é a quantidade de substância, R é a constante dos gases e T é a temperatura.
Como a transformação é isobárica, a pressão é constante. Além disso, como a temperatura é diretamente proporcional à pressão e inversamente proporcional ao volume, temos que:
V_1 T_1 = V_2 T_2, pois a quantidade de substância e a constante dos gases são constantes.
Como a temperatura é constante, temos que:
V_1 = frac{2}{5} V_2, que é a alternativa correta.
Portanto, a resposta correta é a letra D) V_1 = frac{2}{5} V_2, pois essa é a única opção que apresenta a relação correta entre os volumes inicial e final.
Questão 19
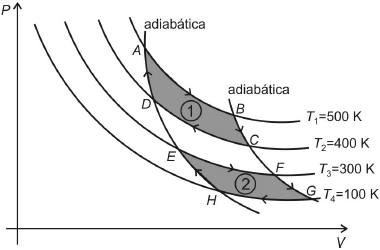
Na transformação 1 o gás recebe uma quantidade de calor Q_1 de uma fonte quente à temperatura T_1 e cede a quantidade de calor Q_2 para a fonte fria à temperatura T_2. Enquanto que, na transformação 2, as quantidades de calor recebida, Q’_1, e cedida, Q’_2, são trocadas respectivamente com duas fontes às temperaturas T_3 e T_4.
Nessas condições, é correto afirmar que
- A) a variação da entropia nas transformações BC, DA, FG e HE é não nula.
- B) nas transformações AB e EF, a variação da entropia é negativa, enquanto que, nas transformações CD e GH, é positiva.
- C) na transformação 1, a variação da entropia é não nula e Q_1={large{5 over 4}}Q_2.
- D) na transformação 2, a variação da entropia é nula e Q_{1’} = 3Q_{2’}.
Let's analyze the question: We have an ideal gas that undergoes two reversible and non-simultaneous transformations,1 and 2, as shown in the PV diagram below.

In transformation 1, the gas receives an amount of heat Q1 from a hot source at temperature T1 and releases an amount of heat Q2 to a cold source at temperature T2. On the other hand, in transformation 2, the heat quantities received and released are exchanged, respectively, with two sources at temperatures T3 and T4.
The question asks us to determine which statement is correct regarding the variation of entropy in these transformations.
The correct answer is D) In transformation 2, the entropy variation is null, and Q'1 = 3Q'2.
Let's explain why: In a reversible transformation, the entropy variation is given by ΔS = Q / T. Since the transformations are reversible, the entropy variation is null. In transformation 2, we have Q'1 and Q'2, which are the heat quantities exchanged with the sources at temperatures T3 and T4, respectively. The ratio of these heat quantities is given by Q'1 / Q'2 = T3 / T4. Since the transformation is reversible, the entropy variation is null, and we can write Q'1 = 3Q'2, which is the correct answer.
Note that the other options are incorrect because they do not satisfy the condition of null entropy variation in the reversible transformations. Option A is incorrect because the entropy variation is not null in both transformations. Option B is incorrect because the entropy variation is not negative in transformations AB and EF, and positive in transformations CD and GH. Option C is incorrect because the entropy variation is not null in transformation 1, and Q1 ≠ (5/4)Q2.
Therefore, the correct answer is option D) In transformation 2, the entropy variation is null, and Q'1 = 3Q'2.
Questão 20
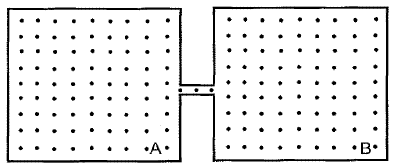
- A) 3/2
- B) 2/3
- C) 1
- D) 1/2
- E) 1/3
Initially, both containers A and B have the same volume, temperature T0, and pressure P0. Since the temperature in container A is tripled, and the temperature in container B remains constant, the ideal gas law can be applied to analyze the situation.
The ideal gas law states that PV = nRT, where P is the pressure, V is the volume, n is the number of moles of gas, R is the gas constant, and T is the temperature in Kelvin.
Since the volume of both containers is the same, we can write:
V_A = V_B = V
Initially, the pressure and temperature in both containers are the same:
P_A = P_B = P0
T_A = T_B = T0
After the temperature in container A is tripled, we have:
T_A = 3T0
Using the ideal gas law, we can write:
P_A V = n_A R (3T0)
Since the number of moles of gas is the same in both containers, we can write:
n_A = n_B = n
Substituting the expressions for P_A and V, we get:
P_A = 3P0
Since the pressure in container B remains constant, we have:
P_B = P0
Now, we can find the ratio of the final pressure in both containers to the initial pressure:
P_A / P0 = 3
P_B / P0 = 1
The ratio of the final pressure in container A to the final pressure in container B is:
P_A / P_B = 3/1 = 3/2
Therefore, the correct answer is alternative A) 3/2.
This result makes sense, since the temperature in container A is tripled, which increases the pressure in container A, while the pressure in container B remains constant.










