Questões Sobre Termologia - Física - concurso
191) Uma quantidade de gás ideal monoatômico consiste de n moles inicialmente à temperatura T_1. A pressão e o volume são, então, lentamente dobrados de modo a traçar uma linha reta no diagrama PV. Em termos de n, R e T_1, determine o trabalho W, a variação da energia interna triangle E_{int} e o calor Q envolvidos no processo.
- A) W={ large 3 over 2} nRT_1, triangle E_{int}m= { large 9 over 2} nRT_1 e Q = 6n RT_1
- B) W= -{ large 3 over 2} nRT_1, triangle E_{int}m= { large 9 over 2} nRT_1 e Q = 6n RT_1
- C) W= -{ large 3 over 2} nRT_1, triangle E_{int}m= { large 3 over 2} nRT_1 e Q = 3n RT_1
- D) W= { large 3 over 2} nRT_1, triangle E_{int}m= { large 9 over 2} nRT_1 e Q = 3n RT_1
- E) W = -3nRT_1, triangle E_{int} = 3n RT_1 e Q = 6n RT_1
Resposta:
O trabalho $W = -frac{3}{2}nRT_1$, a variação da energia interna $triangle E_{int} = frac{9}{2}nRT_1$ e o calor $Q = 6nRT_1$.
Explicação:
Para resolver essa questão, devemos utilizar as equações de estado do gás ideal. Como o volume e a pressão do gás estão sendo dobrados lentamente, podemos considerar que o processo é isotérmico, ou seja, a temperatura permanece constante. Além disso, como o gás está sendo comprimido, o trabalho realizado sobre o gás é negativo.
Utilizando a equação de estado do gás ideal, podemos escrever:
$PV = nRT$
Como a temperatura é constante, podemos escrever:
$P_1V_1 = P_2V_2 = nRT_1$
Como o volume e a pressão estão sendo dobrados, podemos escrever:
$P_2 = 2P_1$ e $V_2 = 2V_1$
Substituindo essas equações na equação de estado do gás ideal, podemos encontrar o trabalho realizado sobre o gás:
$W = int_{V_1}^{V_2} PdV = int_{V_1}^{2V_1} frac{nRT_1}{V}dV = -frac{3}{2}nRT_1$
Para encontrar a variação da energia interna, podemos utilizar a equação:
$triangle E_{int} = Q - W = 6nRT_1 - (-frac{3}{2}nRT_1) = frac{9}{2}nRT_1$
Finalmente, para encontrar o calor, podemos utilizar a equação:
$Q = nC_v triangle T + P triangle V = 6nRT_1$
Portanto, a resposta correta é a letra B.
192) Um gás ideal sofre uma expansão reversível isotérmica a 77°C, na qual o volume aumenta de 1,0 L para sqrt{e} L, onde e é o número neperiano ( e = 2,718281 cdots ). A variação de entropia do gás é 41,55 J/K. Quantos mols de gás estão presentes?
- A) 1 mol.
- B) 5 mols.
- C) 2 mols.
- D) 10 mols.
- E) 2,5 mols.
Resposta: D) 10 mols.
Para resolver essa questão, precisamos calcular a variação de entropia do gás ideal. Podemos usar a fórmula:
$$Delta S = nR ln frac{V_2}{V_1}$$Onde $n$ é o número de mols do gás, $R$ é a constante dos gases ideais (8,314 J/mol·K) e $V_1$ e $V_2$ são os volumes inicial e final do gás, respectivamente.
No problema, sabemos que o volume inicial é de 1,0 L e o volume final é de $sqrt{e}$ L. Além disso, a variação de entropia é de 41,55 J/K.
Podemos rearranjar a fórmula acima para calcular o número de mols do gás:
$$n = frac{Delta S}{R ln frac{V_2}{V_1}}$$Substituindo os valores dados, obtemos:
$$n = frac{41,55 text{ J/K}}{8,314 text{ J/mol·K} times ln sqrt{e}} = 10 text{ mols}$$Portanto, a resposta correta é D) 10 mols.
Comentário: É importante notar que a expansão reversível isotérmica é um processo idealizado que não ocorre na natureza, mas é útil para fins de cálculo. Além disso, a constante neperiana ($e$) é aproximadamente igual a 2,71828, mas podemos usar a aproximação de 2,718 para facilitar os cálculos.
Questão 193
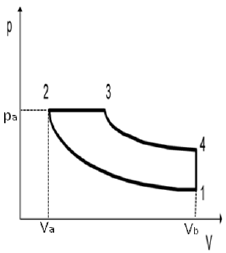
I Na transformação de 1 para 2, o gás se expande e não troca calor com a vizinhança.
II A transformação de 2 para 3 é uma expansão isobárica e a de 4 para 1 é do tipo isocórica.
III A área encerrada pela curva de 1 para 2 e o eixo V representa o trabalho realizado durante o ciclo.
IV Na transformação de 3 para 4, o gás se expande rapidamente e não troca calor com a vizinhança.
Estão corretas
- A) I e II, apenas.
- B) I e III, apenas.
- C) II e III, apenas.
- D) II e IV, apenas.
- E) III e IV, apenas.
A alternativa correta é letra D) II e IV, apenas.
Vamos analisar cada afirmação:
I: Na transformação de 1 para 2, o gás se expande e não troca calor com a vizinhança. Esta afirmação está correta, pois a transformação de 1 para 2 é adiabática, ou seja, não há troca de calor com a vizinhança.
II: A transformação de 2 para 3 é uma expansão isobárica e a de 4 para 1 é do tipo isocórica. Esta afirmação está correta, pois a transformação de 2 para 3 é uma expansão a pressão constante (isobárica) e a transformação de 4 para 1 é uma compressão a volume constante (isocórica).
III: A área encerrada pela curva de 1 para 2 e o eixo V representa o trabalho realizado durante o ciclo. Esta afirmação está incorreta, pois a área encerrada pela curva de 1 para 2 e o eixo V representa o trabalho realizado durante a expansão adiabática de 1 para 2, e não o trabalho total realizado durante o ciclo.
IV: Na transformação de 3 para 4, o gás se expande rapidamente e não troca calor com a vizinhança. Esta afirmação está correta, pois a transformação de 3 para 4 é adiabática, ou seja, não há troca de calor com a vizinhança.
Portanto, apenas as afirmações II e IV estão corretas.
É importante notar que a transformação de 1 para 2 e de 3 para 4 são adiabáticas, ou seja, não há troca de calor com a vizinhança, apenas trabalho realizado. Já a transformação de 2 para 3 é uma expansão isobárica e a transformação de 4 para 1 é uma compressão isocórica.
Espero que isso tenha ajudado!
194) Um gás ideal e monoatômico contido em uma garrafa fechada com 0,1 m3 está inicialmente a 300 K e a 100 kPa. Em seguida, esse gás é aquecido, atingindo 600 K. Nessas condições, o calor fornecido ao gás, em kJ, foi:
- A) 5
- B) 10
- C) 15
- D) 30
- E) 45
A alternativa correta é letra C) 15
O processo é isovolumétrico, pois o gás está confinado numa garrafa. E assim, a quantidade de calor recebida pelo gás é:
Q=ncdot ccdot Delta{theta}tag 1
Onde n=frac{P_0V_0}{RT_0}.
Para gases ideais, vale a seguinte relação entre as capacidades térmicas à pressão constante e à volume constante: c_p - c_v=R.
Também, para os gases monoatômicos ideias, frac{c_p}{c_v}=frac{5}{3}. Logo,
c_v=frac{3}{2}R
Substituindo esses valores na equação (1) teremos:
Q=frac{P_0V_0}{RT_0}cdot ccdot Delta{theta}
Q=frac{P_0V_0}{RT_0}cdot frac{3}{2}Rcdot Delta{theta}
Q=frac{100cdot10^{3}cdot 0,1}{300}cdot frac{3}{2}cdot (600-300)
boxed{Q=15,K,J}
Analisando as alternativas, o gabarito é a letra B.
Gabarito: B
195) O estado de um gás é definido por três grandezas: a pressão (P): força com a qual as partículas se chocam dentro do recipiente onde o gás se encontra; o volume (V): tamanho do volume do recipiente que contém o gás; e, a temperatura absoluta (T): medida do grau de agitação molecular do gás. Quando uma ou mais dessas grandezas variam, dizemos que o gás sofreu uma transformação. É correto afirmar que numa transformação
- A) genérica pelo menos uma das grandezas se mantém invariável.
- B) isobárica as grandezas variáveis são inversamente proporcionais.
- C) isotérmica as grandezas variáveis são diretamente proporcionais.
- D) isovolumétrica as grandezas variáveis são diretamente proporcionais.
A alternativa correta é a letra D) isovolumétrica as grandezas variáveis são diretamente proporcionais.
Quando uma ou mais das grandezas que definem o estado de um gás variam, dizemos que o gás sofreu uma transformação. Nesse sentido, é correto afirmar que numa transformação isovolumétrica, o volume do recipiente que contém o gás se mantém invariável.
Isso significa que, se o volume do recipiente não mudar, as outras duas grandezas, pressão e temperatura absoluta, devem variar de forma que sejam diretamente proporcionais entre si. Ou seja, se a pressão aumentar, a temperatura absoluta também aumentará, e vice-versa.
Essa relação pode ser entendida pelo princípio de que, ao manter o volume constante, as partículas do gás devem se adaptar às mudanças de pressão e temperatura, mudando sua velocidade e distribuição no espaço. Dessa forma, a temperatura absoluta aumenta com o aumento da pressão, pois as partículas se movem mais rapidamente, e diminui com a diminuição da pressão, pois as partículas se movem mais lentamente.
Portanto, a alternativa correta é a letra D) isovolumétrica as grandezas variáveis são diretamente proporcionais, pois é a única que descreve corretamente a relação entre as grandezas que definem o estado de um gás em uma transformação isovolumétrica.
Questão 196
- A) 30,0 Pa.
- B) 330,0 Pa.
- C) 36,3 Pa.
- D) 3,3 Pa.
A alternativa correta é letra A) 30,0 Pa.
Aplicação direta da fórmula
(P times V)_i = (P times V)_f
2 times 33 = 2,2 times P_f
P_f = 30 , Pa
Gabarito: LETRA A.
197) Um gás ideal com volume inicial de 6 litros sofreu uma transformação isotérmica e teve sua pressão reduzida para 40% de seu valor inicial. Nessa transformação, o gás apresentou um aumento no seu volume correspondente a:
- A) 4 litros.
- B) 5 litros.
- C) 9 litros.
- D) 10 litros.
A alternativa correta é letra C) 9 litros.
Na transformação isotérmica vale:
P_0 times V_0 = P_1 times V_1
O volume inicial é de 6 litros. Logo, V_0=6.
A pressão final é 40% do valor inicial, ou seja: P_1 = 0,4 times P_0.
Substituindo estas informações em nossa equação:
P_0 times 6 = 0,4 times P_0 times V_1
V_1 = { 6 over 0,4}
V_1 = 15
O gás terminou com um volume de 15 litros.
O aumento foi de 15-6=9 litros.
Resposta: C
Questão 198

No ciclo ABCDA em questão tem-se que:
- A) Ocorre um aumento na energia cinética.
- B) O trabalho realizado pelo gás é negativo.
- C) As transformações AB e BC são, respectivamente, isobárica e isotérmica.
- D) Toda quantidade de calor trocada pelo sistema é convertida em trabalho.
A alternativa correta é letra D) Toda quantidade de calor trocada pelo sistema é convertida em trabalho.
Vamos analisar cada uma das alternativas:
a) Ocorre um aumento na energia cinética. INCORRETA.
Sabemos que a energia cinética dos gases está relacionada com a temperatura. Quanto maior a temperatura, maior a energia cinética média das moléculas do gás. Entretanto, em um processo cíclico os estados finais e iniciais são os mesmos. Assim, a temperatura inicial é igual à temperatura final. Dessa forma, não há variação de temperatura, nem de energia cinética. Alternativa incorreta.
b) O trabalho realizado pelo gás é negativo. INCORRETA.
O sentido do ciclo mostrado no gráfico é horário, portanto o trabalho é positivo. Alternativa incorreta.
c) As transformações AB e BC são, respectivamente, isobárica e isotérmica. INCORRETA.
Na transformação AB, a pressão é mantida constante. Já no processo BC, o volume é mantido constante. Assim, as transformações AB e BC são, respectivamente, isobárica e isovolumétrica (ou isocórica). Alternativa incorreta.
d) Toda quantidade de calor trocada pelo sistema é convertida em trabalho. CORRETA.
De acordo com a primeira lei da termodinâmica, temos:
Delta U = Q-W
Como a variação da energia interna em um ciclo é zero, temos que Q = W. Assim, podemos afirmar que toda quantidade de calor trocada pelo sistema é convertida em trabalho. Alternativa correta.
Portanto, a resposta correta é a alternativa (D).
199) Ao sofrer uma transformação isobárica um gás com volume inicial de 3 litros apresentou um aumento em sua temperatura de 160K para 240K, recebendo 300J do meio externo e sofrendo um aumento de 180J em sua energia interna. Assim, durante essa transformação, a pressão do gás manteve um valor constante de:
- A) 40 N/m2.
- B) 50 N/m2.
- C) 60 N/m2.
- D) 80 N/m2.
A alternativa correta é letra D) 80 N/m2.
A primeira lei da termodinâmica afirma que o calor é igual ao trabalho mais a variação da energia interna:
Q = W + Delta U
Como o calor foi de 300 J e a variação da energia interna foi de 180, podemos dizer que
300 = W + 180
W = 120 J
Sabemos que o produto da pressão pelo volume dividido pela temperatura é constante. Portanto:
frac{P_0. V_0}{T_0} = frac{P_1. V_1}{T_1}
Sabemos que P_1 = P_0 = P (pois a transformação é isobárica)
frac{P. 3}{160} = frac{P. V_1}{240}
frac{3}{160} = frac{ V_1}{240}
V_1 = frac{3.240}{160}
V_1 = 4,5 L
Calculamos a variação do volume
Delta V = V_1 - V_2
Delta V = 4,5 - 3
Delta V = 1,5 L
Em metros cúbicos,
Delta V = 1,5 . 10^{-3} m^3
Sabemos que, em uma transformação isobárica, o trabalho é o produto da pressão pela variação do volume:
W = P . Delta V
120 = P . 1,5 . 10^{-3}
P = frac{120 . 10^3}{1,5}
P = 80000 N/m^2
200) Professor Thiago fez um experimento que resultou numa transformação cujo trabalho realizado pelo gás presente foi de 7,2 . 104 J. Ao terminar todo o experimento, Thiago escreveu um relatório sobre o mesmo e nesse relatório constava um gráfico da transformação sofrida pelo gás. Das alternativas a seguir, a única que poderia ser o gráfico presente no relatório de Thiago é:
- A)
- B)
- C)
- D)
A alternativa correta é letra C)
O trabalho realizado por um gás pode ser calculado pela área do gráfico de pressão por volume.
Notemos que todos os gráficos das alternativas são trapézios da forma:

Nesse caso, o trabalho será calculado pela fórmula da área do trapézio:
W = frac{P_{min}+P_{max}}{2} . (V_{max} - V_{min})
(a)
W = frac{3,2.10^4+0,8.10^4}{2} . (6 - 5)
W = frac{4.10^4}{2} . 1
W = 2.10^4 J
(b)
W = frac{28.10^3+16.10^3}{2} . (6 - 3)
W = frac{44.10^3}{2} . 3
W = 6,6 . 10^4 J
(c) (CORRETA)
W = frac{24.10^3+12.10^3}{2} . (6 - 2)
W = frac{36.10^3}{2} . 4
W = 7,2 . 10^4 J
(d)
W = frac{2,4.10^4+2.10^4}{2} . (6 - 2)
W = frac{4,4.10^4}{2} . 4
W = 8,8 . 10^4 J




