Questões Sobre Termologia - Física - concurso
2061) Uma certa quantidade de um gás ideal ocupa um volume de 200 L sob pressão de 2,0.105 Pa a 27oC.
- A) 7,2.103 J.
- B) 4,0.103 J.
- C) 3,6.103 J.
- D) 2,0.103 J.
- E) nula.
A alternativa correta é letra C) 3,6.103 J.
Gabarito: LETRA C.
Na situação inicial do gás, temos:
begin{cases} P_0 = 2,0 times 10^5 , Pa \ \ V_0 = 200 , l = 0,2 , m^3 \ \ T_0 = 27°C = 300 , Kend{cases}
Como a temperatura final de cada tentativa é a mesma, a variação da energia interna do gás é igual para ambos. Assim, podemos escrever:
Delta U_1 = Delta U_2
Então, de acordo com a primeira lei da termodinâmica, podemos escrever:
Q_1 - W_1 = Q_2 - W_2
Como o volume é mantido constante na primeira tentativa, o gás não realiza trabalho. Então, substituindo W_1 = 0 na equação acima, temos que:
Q_1 - 0 = Q_2 - W_2
Q_1 = Q_2 - W_2
Q_2 - Q_1 = W_2 tag 1
Como a pressão é mantida constante na tentativa 2, temos que P_2 = P_0. Além disso, o trabalho realizado pelo gás na tentativa 2 é dado por W_2 = P_2 cdot Delta V. Então, a equação (1) pode ser escrita da seguinte maneira:
Q_2 - Q_1 = P_0 cdot left( V_2 - V_0 right) tag 2
De acordo com a lei dos gases ideais, podemos escrever:
dfrac { P_0 cdot V_0 } { T_0 } = dfrac { P_2 cdot V_2 } { T_2 }
Como P_2 = P_0, temos
dfrac { cancel {P_0} cdot V_0 } { T_0 } = dfrac { cancel {P_0} cdot V_2 } { T_2 }
V_2 = dfrac { T_2 } { T_0 } cdot V_0
Substituindo V_2 na equação (2), temos:
Q_2 - Q_1 = P_0 cdot left( dfrac { T_2 } { T_0 } cdot V_0 - V_0 right)
Q_2 - Q_1 = P_0 cdot V_0 cdot left( dfrac { T_2 } { T_0 } - 1 right)
Substituindo T_2 = 27°C + 27°C = 54°C = 327 , K e os valores do enunciado, a equação se torna:
Q_2 - Q_1 = 2,0 times 10^5 cdot 0,2 cdot left( dfrac { 327 } { 300 } - 1 right)
Q_2 - Q_1 = 3,6 times 10^{3} , J
Portanto, a resposta correta é a alternativa (c).
Questão 2062
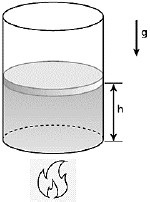
Neste caso, a força que a pessoa necessita fazer é igual a:
- A) 50 N.
- B) 100 N.
- C) 200 N.
- D) 250 N.
- E) 300 N.
A alternativa correta é letra A) 50 N.
Gabarito: LETRA A.
Vamos representar o cilindro nas três situações: 1 - situação inicial, 2 - gás aquecido e 3 - êmbolo de volta à posição devido à ação de F:
Como o êmbolo está livre durante o aquecimento, a temperatura e o volume do gás aumentam, enquanto a pressão é mantida constante. De acordo com a primeira lei da termodinâmica, parte do calor fornecido pela fonte é convertido em trabalho ao elevar o êmbolo, e o restante é utilizado para elevar a energia interna do gás, aumentando sua temperatura.
É possível utilizar diversos caminhos para fazer o gás retornar ao volume V_1. Entretanto, aqui está o problema da questão: o enunciado não fornece um caminho específico. Porém, para fins de estudos, vamos adotar que a temperatura se mantenha constante após o aquecimento. Então, de acordo com a lei geral dos gases ideais, podemos escrever:
dfrac { { P_1 } cdot V_1 } { T_1 } = dfrac { { P_3 } cdot V_3 } { T_3 }
Como T_3 = T_2, temos:
dfrac { { P_1 } cdot V_1 } { T_1 } = dfrac { { P_3 } cdot V_3 } { T_2 }
Porém, V_3 = V_1. Logo,
dfrac { { P_1 } cdot cancel { V_1} } { T_1 } = dfrac { P_3 cdot cancel {V_1} } { T_2 }
P_3 = dfrac { T_2 } { T_1 } cdot P_1
Entretanto, a pressão P_3 é a soma da pressão atmosférica com a pressão exercida pela força F. Assim, podemos escrever:
P_1 + P' = dfrac { T_2 } { T_1 } cdot P_1
P' = dfrac { T_2 } { T_1 } cdot P_1 - P_1
P' = left( dfrac { T_2 } { T_1 } - 1 right) cdot P_1
Então,
P' = left( dfrac { 375 } { 300 } - 1 right) cdot 1,0
P' = 0,25 , atm
Como 1 , atm approx 1,0 times 10^5 , Pa = 1,0 times 10^5 , N/m^2, temos:
P' = 0,25 times 10^5 , N/m^2
Lembrando que P' = dfrac F A, temos:
F = P' cdot A
F = 0,25 times 10^5 , N/cancel{m^2} cdot 20 times 10^{-4} cancel{m^2}
F = 50 , N
Portanto, a resposta correta é a alternativa (a).
2063) As panelas elétricas funcionam com uma resistência que aquece uma chapa de metal até uma temperatura específica. Essa temperatura é controlada por alguns dispositivos; entre eles o fusível térmico, que desarma ou “queima” ao atingir a temperatura de 165° C, protegendo o restante do circuito contra outros danos. Uma panela elétrica, com um rendimento de 76% e capacidade térmica 44 cal/°C, inicialmente a 25° C, foi projetada para trabalhar com uma potência elétrica de 440 W quando ligada em uma tomada de 127 V. Assim, ligando-se essa panela sem água, ela irá aquecer até ser desligada pelo desarme do fusível, que ocorrerá após um tempo de, aproximadamente:
- A) 1 minuto e 12 segundos.
- B) 1 minuto e 17 segundos.
- C) 1 minuto e 22 segundos.
- D) 1 minuto e 29 segundos.
- E) 1 minuto e 32 segundos.
A alternativa correta é letra B) 1 minuto e 17 segundos.
Gabarito: LETRA B.
Sabemos que a potência é dada pela razão entre a energia fornecida e o intervalo de tempo:
P = dfrac { E } { Delta t }
Como a energia fornecida pela panela corresponde ao calor utilizado para aquecer a resistência, podemos escrever:
P_{útil} = dfrac { Q } { Delta t }
Sendo eta a eficiência da panela, temos
eta cdot P_{total} = dfrac { Q } { Delta t }
Delta t = dfrac { Q } { eta cdot P_{total} } tag 1
Lembrando que a capacidade térmica é dada por
C = dfrac Q { Delta T}
Ou ainda,
Q = C cdot Delta T
A equação (1) se torna:
Delta t = dfrac { C cdot Delta T } { eta cdot P_{total} } tag 2
Lembrando que 1, cal approx 4,2 , J, podemos substituir os valores do enunciado na equação (2):
Delta t = dfrac { 44 cdot 4,2 cdot left( 165 - 25 right) } { 0,76 cdot 440 }
Delta t approx 77,4 , s
Delta t approx 1 , min , 17 , s
Portanto, a resposta correta é a alternativa (b).
2064) Sabemos que a água ferve ao nível do mar a temperatura de 100ºC. Supondo um final de semana ensolarado e uma ida à praia, ao subir a serra sentido litorâneo, em uma elevação de 1000m, qual o comportamento da água quando desejamos fervê-la?
- A) O calor específico da água aumenta, logo para fervê-la é necessário aumentar a temperatura.
- B) O calor específico da água diminui, logo para fervê-la é necessário aumentar a diminuição da temperatura.
- C) A água não ferve.
- D) A água ferve na mesma temperatura, já que a pressão atmosférica não influencia esse sistema.
- E) A água ferve a uma temperatura menor devido à menor pressão atmosférica.
A alternativa correta é letra E) A água ferve a uma temperatura menor devido à menor pressão atmosférica.
A pressão atmosférica ao nível do mar é de 1 atm (10cdot10^{5},N/m^2). Entretanto, à medida que alcançamos altitudes mais elevadas, a pressão atmosférica diminui e a temperatura de ebulição também diminui, pois será necessário menos força para que os vapores de água vençam a pressão atmosférica.
Gabarito: E
Questão 2065

Considerando-se que o telhado de uma casa tem 6m de comprimento, 8m de largura e 0,25m de espessura, e seja feito de uma camada plana de concreto cuja condutividade térmica é de 0,8W/mK; e as temperaturas das faces interna e externa do telhado são 15ºC e 4ºC, respectivamente, nessas condições, a taxa de transferência de calor por condução, em watts, através do telhado, é:
- A) Menor que 1.500
- B) Maior que 1.500 e menor que 1.700
- C) Maior que 1.700 e menor que 1.900
- D) Maior que 1.900
A alternativa correta é letra B) Maior que 1.500 e menor que 1.700
O calor será transferido do lado de maior temperatura para o de menor temperatura do telhado. Pela lei de Fourier temos:
Phi=kcdotfrac{ADelta{T}}{L}
Usando as informações apresentadas na fórmula acima teremos:
Phi=0,8cdotfrac{6times8cdot(15-4)}{0,25}=1689,6,W
Gabarito: B
2066) Mudança da água do estado sólido para o estado gasoso. Este processo é definido como:
- A) Condensação.
- B) Sublimação.
- C) Solidificação.
- D) Vaporização.
- E) Fusão.
A alternativa correta é letra B) Sublimação.
Sublimação é a mudança do estado sólido diretamente para o estado gasoso, o que pode não ser muito intuitivo à primeira vista, uma vez que estamos acostumados a visualizar líquidos se transformar em vapor. Entretanto, o fenômeno da sublimação pode ocorrer em temperatura ambiente.
Gabarito: B
2067) A temperatura de 39,5 °C, ao ser transformada na escala Kelvin (K), resultará no valor aproximado de
- A) 140
- B) 212
- C) 313
- D) 273
- E) 373
A alternativa correta é letra C) 313
A fórmula que relaciona a temperatura nas escalas Kelvin (K) e Celsius (°C) é a seguinte:
T_k=T_c+273
boxed{T_k=39,5+273=312,5}
Gabarito: C
2068) Em 1769, James Watt inventou uma máquina que não necessitava da força animal ou humana para gerar movimento. Esse feito revolucionou a atividade industrial e foi o embrião dos motores à combustão interna utilizados atualmente. O funcionamento do motor de quatro tempos pode ser explorado nas aulas de ciências, ao abordar o comportamento das reações de combustão e as transformações gasosas. Considerando o tema, analise os itens a seguir.
- A) I e II, apenas.
- B) II e III, apenas.
- C) I e III, apenas.
- D) I e IV, apenas.
- E) IV, apenas.
A alternativa correta é letra A) I e II, apenas.
Analisemos as alternativas:
I. As reações de combustão são espontâneas. Falso. As reações de combustão precisam de energia para haver queima dos gases, que ocasionam a combustão.
II. Uma transformação gasosa isobárica ocorre a temperatura constante. Falso. Uma transformação isobárica ocorre à pressão constante.
III. Uma compressão gasosa adiabática não envolve trocas de calor. Correto. A transformação adiabática é aquela em que não há trocas de energia térmica entre o sistema e o meio exterior.
IV. Os gases aquecidos apresentam pressão total maior comparado aos gases resfriados. Correto. Os gases, quando especialmente se encontram em ambientes confinados, terão pressão maior comparado aos gases resfriados.
Gabarito: A
Questão 2069

Considerando as informações fornecidas e o disposto na imagem, no que se refere à etapa de condensação dessa substância hipotética, assinale a alternativa correta.
- A) Ocorre no intervalo de temperaturas entre 80 °C e 25 °C.
- B) Ocorre no intervalo de temperaturas entre 250 e 150 °C.
- C) Ocorre na temperatura fixa de 150 °C.
- D) Ocorre no intervalo de temperaturas entre 150 e 80 °C.
- E) Ocorre a exatamente 80 °C.
A alternativa correta é letra C) Ocorre na temperatura fixa de 150 °C.
Como a substância encontra-se inicialmente no estado gasoso, o primeiro estágio de estabilização de temperatura no resfriamento representa a condensação da substância (mudança do estado gasoso para o estado líquido). Conforme o gráfico, o primeiro estágio ocorre na temperatura 150^oC.
Gabarito: C
2070) Uma amostra de água (150 g) resfria de 70 °C para 20 °C. A quantidade de calor liberada da água para o ambiente será de:
- A) -7.500 cal.
- B) 10.500 cal.
- C) 1.500 cal.
- D) -10.500 cal.
- E) 13.500 cal.
A alternativa correta é letra A) -7.500 cal.
A quantidade de calor recebida ou cedida por um corpo é dada por:
Q=mcDelta{T}
Onde c é calor específico da água e T é a temperatura.
Q=150cdot1cdot(70-20)
Q=7500,Cal
Como o calor foi cedido, o sinal deve ser negativo: -7500,Cal.
Gabarito: A
